
методичка по Химии
.pdf
Когда белые пары HCl достигают сосуда-приемника, в последнем образуется кислая среда, на которую указывает красный цвет раствора. Напишите уравнение происходящей реакции деструкции.
Задание 2. Деструкция полиметилметакрилата (плексиглас)
В чистую высушенную пробирку для перегонки засыпьте 1/3 пробирки стружки полиметилметакрилата, присоедините газоотводная трубка, затем подставьте пустой приемник. Нагревание происходит до тех пор, пока из полимера конденсируются и собираются в приемнике пары в виде желтоватой жидкости. Если на эту жидкость подействовать бромной водой, то она обесцветится, что говорит о наличии двойных связей в получившемся продукте. Имеются ли двойные связи в исходном продукте, подвергающемся деструкции, т.е. полиметилметакрилате?
Напишите уравнение деструкции полиметилметакрилата, имея в виду, что при этом получается его мономер, метилметакрилат и взаимодействие метилметакрилата с бромной водой.
Задание 3. Деполимеризация каучука В чистую сухую пробирку засыпьте примерно 1/8 мелко нарезанного
каучука, присоедините газоотводная трубка, в приемник налейте раствор КMnO4 с водой. При довольно продолжительном нагревании (10-15 мин) из каучука выделяется коричнево-желтоватые пары изопрена конденсирующиеся в жидкость, обесцвечивающие, благодаря наличию двойных связей, раствор перманганата в приемнике.
Уравнение деполимеризации натурального каучука:
Напишите реакцию взаимодействия изопрена с бромной водой. Каков ее механизм? Напишите реакцию взаимодействия перманганата калия с изопреном, составьте электронный баланс этой реакции.
КОНТРОЛЬНЫЕ ВОПРОСЫ
3.Что такое пластмассы?
4.Что такое деполимеризация и в каких условиях она осуществляется?
5.Какой продукт получается при деструкции полиметилметакрилата? Какова его формула?
6.Какой продукт получается при деструкции поливинилхлорида? Как это можно проверить? Каковы его формулы?
100
7.Что происходит при сухой перегонке натурального каучука? К каким углеводородам (предельным или непредельным) относится получившийся продукт? Как это проверить?
8.Какое отношение политетрафторэтилена к нагреванию?
9.Почему вышедшие из употребления изделия из капрона могут быть подвергнуты повторной переработке?
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Коровин Н.В. Курс общей химии. – М.: Высшая школа, 2001. –
С. 450-466.
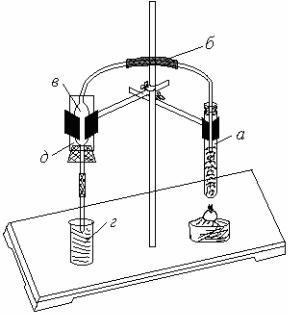
а – пробирка для нагревания пластмассы; б – газоотводная трубка; в – ловушка;
г – приемник для продуктов деструкции; д – резервуар для охлаждения.
Рис. Прибор для деструкции пластмасс
101
ЛАБОРАТОРНАЯ РАБОТА № 45
ДИСПЕРСНЫЕ СИСТЕМЫ И ИХ СВОЙСТВА
Цель работы: ознакомление с методами получения дисперсных систем и изучение их поверхностных коллоидно-химических свойств.
Рабочее задание:
1.Конденсационным методом получить гидрозоль гидроксида железа, очистить от примеси электролита методом диализа, изучить коагуляцию гидрозоля под действием электролита.
2.Установить роль поверхностных явлений в дисперсионном методе получения эмульсии керосина в воде.
СВЕДЕНИЯ ИЗ ТЕОРИИ
Дисперсные системы широко распространены в природе, применяются в технике, строительстве в виде пылей, дымов, туманов, пен, тканевой жидкости растений и живых организмов, а также цементов, в виде эмульсионных смазочно-охлаждающих жидкостей, лаков, красок, тканей, различных порошкообразных строительных материалов, пенопластов и т.д.
Классическим примером сложных дисперсных систем являются грунты.
Дисперсными называются гетерогенные системы, содержащие две (или более) фазы, одна из которых в виде частичек распределена в другой. Совокупность раздробленных частиц называется дисперсной фазой, а фаза, в которой распределены дисперсные частицы – дисперсионной средой.
Системы, содержащие частицы с размером 10-9 – 10-7м, называются коллоидными или золями. К дисперсным системам относятся также эмульсии и суспензии, имеющие размер частиц 10-7 – 10-5м и более.
Коллоидные системы могут быть получены конденсационным, дисперсионным методами и методом пептизации. Для получения устойчивого гидрозоля необходимо выполнить три условия:
1) вещество дисперсной фазы не должно быть растворимо в дисперсионной среде – в воде;
2)обеспечить коллоидную степень дисперсности частиц;
3)наличие стабилизатора.
Устойчивость золей обеспечивается образованием одноименных зарядов на поверхности коллоидных частиц и возникновением вследствие этого
электрокинетического или дзета ζ-потенциала. Возникает он вследствие адсорбции поверхностью части полярных молекул или ионов из раствора. При
102
этом выполняется правило: адсорбируются те ионы, которые входят в состав ядра мицеллы, или близкие по своей природе к составу ядра и имеются в избытке. Поэтому, зная состав ядра, порядок приготовления золя, ионы, содержащиеся в растворе, можно показать строение и написать формулу мицеллы, имея в виду, что она должна быть электронейтральной.
Ввиду того, что при получении коллоидных систем с помощью химических реакций, например путем гидролиза солей, образуется большое количество электролитов, снижающих устойчивость золей, возникает необходимость их очистки. Осуществляется она с помощью особого метода, называемого диализом. При диализе коллоидная система с примесями истинно растворенных веществ отделяется полупроницаемой мембраной от чистого растворителя. Коллоидные частицы вследствие больших размеров не проходят через нее, а молекулы и ионы проходят и диффундируют в растворитель. При постоянной его смене можно получить практически чистый золь.
Как известно, коллоидные системы являются термодинамически неустойчивыми, так как обладают большим избытком свободной поверхностной энергии. Вследствие этого они имеют низкую агрегативную устойчивость и склонны к коагуляции.
Коагуляция – процесс слипания коллоидных частиц с образованием более крупных агрегатов. Очень часто коагуляция наступает под воздействием электролитов, которые изменяют структуру диффузионного слоя ионов,
уменьшая величину ζ- потенциала до нулевого значения.
Наименьшая концентрация электролита, при которой снижается агрегативная устойчивость и происходит коагуляция за короткий промежуток времени, называется порогом коагуляции.
Пусть молярная концентрация исходного электролита будет С, моль/л, объем его, вызвавший коагуляцию, - V мл., тогда число миллимолей его будет равняться
VC = 1000 CV/1000.
Порог коагуляции равняется
γ = C .V . 1000 мл-молей/л золя,
W
где W – объем взятого золя (мл).
Как отмечено выше, широко распространенными представителями дисперсных систем являются эмульсии и суспензии.
Эмульсией называется дисперсная система, состоящая из двух практически взаимно нерастворимых жидких фаз, одна из которых распределена в другой в виде мельчайших капелек. Эмульсии бывают двух типов: масло в воде (м/в) или вода в масле (в/м). Под маслом понимают любую органическую жидкость, несмешивающуюся с водой.
103
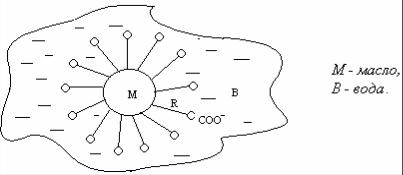
Как правило, эмульсии получают диспергированием (дроблением одной жидкости в другой). При взбалтывании двух чистых жидкостей обычно не получается устойчивой эмульсии, т.е. образующиеся капельки при сталкивании друг с другом сливаются, коалесцируют и эмульсия быстро расслаивается.
Образование устойчивых эмульсий возможно только в присутствии поверхностно-активных веществ (ПАВ) – стабилизаторов или эмульгаторов. Адсорбируясь на поверхности капелек, они уменьшают избыток поверхностной энергии, т.е. поверхностное натяжение, и тем самым увеличивают агрегативную устойчивость эмульсий. Примером ПАВ является обычное натриевое мыло, смесь натриевых солей высших жирных кислот, например, стеарат натрия.
Молекула мыла состоит из полярной 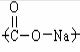 и неполярной части – углеводородного радикала R(СnH2n+1). Его молекулы адсорбируются на поверхности частицы таким образом, что полярной частью обращаются к воде, а углеводородным радикалом к органической фазе (рис.1).
и неполярной части – углеводородного радикала R(СnH2n+1). Его молекулы адсорбируются на поверхности частицы таким образом, что полярной частью обращаются к воде, а углеводородным радикалом к органической фазе (рис.1).
Рис. 1 Схема стабилизации коллоидных частиц
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
Опыт 1. Получение коллоидных растворов (гидрозоля гидроксида железа)
Налейте в две конические коблы А и Б по 100мл дистиллированной воды. Воду в колбе А нагрейте до кипения. Затем в каждую колбу прилейте небольшими порциями (в 3-4 приема) по 10мл 2% раствора FeCl3. Как изменится окраска раствора? Раствор в кобле А прокипятите в течение 1-2 мин, затем охладите холодной водой под краном. Напишите уравнение реакции гидролиза, дайте схему строения и формулу мицеллы гидрозоля Fe(OH)3. Покажите строение двойного электрического слоя, объясните роль дзета-
104
потенциала в опыте. Каким методом получен коллоидный раствор и в чем его сущность? (Полученные растворы сохраните для следующих опытов).
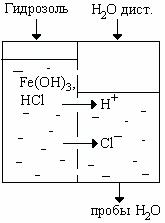
Опыт 2. Диализ гидрозоля гидроксида железа.
Диализатор представляет собой емкость, разделенную на две части полупроницаемой перегородкой (ППП) из целлофана или другого материала. Одну часть заполните гидрозолем, вторую – дистиллированной водой (рис.2.). Уровень гидрозоля должен быть выше уровня воды. Через 15 мин отберите пробы воды в 2 пробирки по 2-3 мл. В первую пробирку добавьте 2-3 капли 0,1н раствора AgNO3, во вторую – 1-2 капли метилоранжа.
Рис. 2. Схема процесса диализа
В отчете объясните причину появления осадка в первой и изменение цвета во второй пробирке.
Какие частицы проходят через мембрану, какие не проникают через
нее?
Опыт 3. Определение порога коагуляции золя гидроксида железа
В пять пробирок (табл.) с помощью мерного цилиндра налейте по 10 мл золя Fe(OH)3, из бюретки необходимое количество воды. Затем поочередно в каждую пробирку введите указанное количество 0,001М раствора Na2SO4 . Сразу же после прибавления электролита каждая пробирка закрывается пробкой, встряхивается для перемешивания растворов и ставится в штатив.
Помутнение отмечается знаком “+” и отсутствие – знаком “–“. Заметьте две соседние пробирки, в одной из которых наблюдается явное помутнение, а в другой помутнение отсутствует. Для расчета порога коагуляции (см. теоретическую часть) берется среднее значение объема электролита между ними.
105
Содержание пробирок
|
|
|
|
|
Таблица |
№ пробирок |
1 |
2 |
3 |
4 |
5 |
Золь |
10 |
10 |
10 |
10 |
10 |
Вода, мл. |
4 |
3 |
2 |
1 |
0 |
Электролит, мл |
1 |
2 |
3 |
4 |
5 |
Общий объем, мл |
15 |
15 |
15 |
15 |
15 |
Результаты |
|
|
|
|
|
наблюдения |
|
|
|
|
|
Опыт 4. Приготовление эмульсии керосина в воде
Впробирку налейте 1 мл приготовленного раствора мыла, а затем туда же прилейте 1 мл керосина. Закройте пробирку резиновой пробкой и содержимое пробирки сильно встряхните. Когда весь керосин будет смешан с мыльным раствором, к полученной массе прилейте 10 мл дистиллированной воды и, закрыв пробирку пробкой, снова несколько раз встряхните содержимое пробирки. Проследите за процессом разрушения эмульсии. Отметьте время начала расслаивания фаз.
Вдругую пробирку налейте 1 мл дистиллированной воды, а затем туда же прилейте 1 мл керосина. Закройте пробирку резиновой пробкой и содержимое пробирки сильно встряхните. Когда керосин будет смешан с водой, к полученной массе прилейте 10 мл дистиллированной воды, и, закрыв пробирку пробкой, снова несколько раз встряхните содержимое пробирки.
Отметьте и сравните время начала и конца расслаивания эмульсии в каждой пробирке. Объясните причину наблюдаемого различия устойчивости полученных эмульсий, используя знания о поверхностных явлениях.
Оформите и сдайте отчет, изучив лекционный материал.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Каково принципиальное различие между коллоидными и истинными растворами?
2.В чем сущность конденсационных и дисперсионных методов получения коллоидных систем? Показать на примерах.
3.В чем причина низкой агрегативной устойчивости коллоидных систем? Как она зависит от величины электрокинетического потенциала
(ζ-потенциала) и поверхностного натяжения?
4.Что такое коагуляция? Какова роль электролита в процессе коагуляции? Что такое порог коагуляции?
5.Каким образом достигается устойчивость эмульсии? Какова роль адсорбции?
106
ЛИТЕРАТУРА
1.Коровин Н.В. Курс общей химии. – М.: Высшая школа, 1990. –
С.172–184.
2.Писаренко А.П., Поспелова К.А., Яковлев А.Г. Курс коллоидной химии.– М.: Высшая школа, 1969. – 248 с.
3.Глинка Н.Л. Общая химия. – М.: Интеграл-Пресс, 2003. – 289 с.
107
ЛАБОРАТОРНАЯ РАБОТА № 46
ТЕПЛОВЫЕ ЭФФЕКТЫ РЕАКЦИИ ГИДРАТАЦИИ ВЯЖУЩИХ ВЕЩЕСТВ
Цель работы: изучить особенности реакции гидратации вяжущих веществ.
Рабочее задание: определить практический тепловой эффект реакции гидратации полуводного гипса, сравнить с теоретическим значением.
СВЕДЕНИЯ ИЗ ТЕОРИИ
Основой схватывания и твердения всех известных неорганических вяжущих веществ являются реакции гидратации, т.е. взаимодействие их с водой. Ее смесь с тонко размолотым вяжущим веществом называется строительным раствором. Последний относится к дисперсным системам типа твердое в жидком и является высококонцентрированной суспензией.
Дисперсной прерывной фазой служит вяжущее вещество; дисперсной, непрерывной фазой (средой) - вода. Следовательно, реакция гидратации является гетерогенной и протекает достаточно медленно, иногда в течение месяцев.
При получении, на стадии обжига, а затем при помоле вяжущих веществ, последние получают избыток внутренней и поверхностной энергии. В ходе реакции она выделяется как свободная энергия G (энергия Гиббса)
|
|
G = H - T S, |
(1) |
где |
Н – |
тепловой эффект реакции, энтальпия реакции, характеризующая |
|
стремление системы к объединению, к порядку, кДж/моль; |
|
||
Т |
– |
термодинамическая температура по шкале Кельвина, К; |
|
|
S – |
изменение энтропии системы в ходе реакции, кДж/моль. |
|
Энтропия отражает движение частиц и характеризует стремление системы к дроблению, разъединению, к беспорядку.
В реакции гидратации, когда образуются кристаллогидраты, энтропия
уменьшается, |
S< 0. |
|
Однако уменьшение имеет небольшую абсолютную величину, поэтому |
||
энтропийный фактор (T S) остается меньше энтальпийного ( |
Н). |
|
В целом |
в реакциях гидратации вяжущих веществ |
Н < 0, поэтому |
G < 0. |
|
|
108
Таким образом, реакции гидратации вяжущих веществ являются экзотермическими и протекают самопроизвольно. В результате получатся соединения – гидратные ноообразования (кристаллогидраты), обладающие меньшей свободной энергией и поэтому термодинамически более устойчивы, чем исходные вещества.
Все соединения в портландцементном клинкере 3CaO·SiО2, 2CaO·SiО2, 3CaO·Al2O3, 4CaO·Al2O3.Fe2O3 являются безводными, но при взаимодействии с водой они образуют гидратные соединения переменного состава.
Основной минерал клинкера – терхкальциевый силикат подвергается гидролизу по реакции
3CaO·Sio2 + nН2О = 2CaO·SiО2· (n-1)H2O + Ca(OH)2 + q, |
(2) |
где q – тепловой эффект реакции при постоянном давлении и постоянной температуре – энтальпия ( Н).
Для экзотермических реакций q = – Н.
Продукт гидролиза – двухкальциевый силикат гидратируется. В результате выделяется трудно растворимый двухкальциевый гидросиликат. Если n = 2,17, то q = 102,5 кДж/моль. Обычно при полной гидратации 3CaO·SiО2 тепловыделение составляет 502,3 Дж/г, причем за трое суток выделяется 75-80% этого количества тепла.
При гидратации двухкальциевого силиката |
|
2CaO·SiО2 + nН2О = 2CaO·SiО2 ·nН2О + q |
(3) |
также выделяется тепло, но в значительно меньшей степени. При n = 1,17 q = 22,6 кДж/моль. Практически тепловой эффект составляет 259,5 Дж/г, поэтому скорость его гидратации значительно меньше – за трое суток выделяется 10% от суммарного теплового эффекта. Двухкальциевый силикат и твердеет очень медленно. Продукт твердения обладает невысокой прочностью в первые недели и месяцы, но на протяжении нескольких лет прочность его неуклонно возрастает.
Наиболее активным минералом цементного клинкера является трехкальциевый алюминат. Тепловыделение при полной его гидратации составляет 850 Дж/г, причем за первые трое суток выделяется не менее 80% от общего количества тепла.
При затворении цемента водой происходит гидратация 3CaO·Al2O3 с образованием гидроалюминатов переменного состава, зависящего от соотношения твердой и жидкой фаз. Наиболее устойчивым является 3CaO·Al2O3·6Н2О. Остальные образующиеся гидроалюминаты постепенно переходят в шестиводный терхкальциевый алюминат. Поэтому общепринятым является следующее уравнение реакции гидратации трехкальциевого алюмината:
109
