
- •Коррозия и защита металлов строительных и конструкционных материалов.
- •Коррозия и защита металлов строительных и конструкционных материалов.
- •с методическими указаниями
- •ЛАБОРАТОРНАЯ РАБОТА № 22
- •Цель работы: изучить процесс образования электродного потенциала, измерить равновесный потенциал металла в водном растворе его соли и ориентировочно определить его химическую активность относительно водорода.
- •ЗАДАЧА ЛАБОРАТОРНОГО ИССЛЕДОВАНИЯ
- •ОПИСАНИЕ ЛАБОРАТОРНОЙ УСТАНОВКИ
- •ПОРЯДОК ВЫПОЛНЕНИЯ И ОФОРМЛЕНИЯ РЕЗУЛЬТАТОВ
- •Равновесный потенциал металла в растворах его соли
- •Раствор
- •Цинк
- •ЛАБОРАТОРНАЯ РАБОТА № 23
- •СВЕДЕНИЯ ИЗ ТЕОРИИ
- •Рис. 1. Схема коррозионного элемента
- •ЛАБОРАТОРНАЯ РАБОТА № 24 Д
- •ГАЛЬВАНИЧЕСКОЕ ЦИНКОВАНИЕ
- •СВЕДЕНИЯ ИЗ ТЕОРИИ
- •Гальванический способ нанесения цинкового покрытия
- •ПРАКТИЧЕСКАЯ ЧАСТЬ
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛАБОРАТОРНАЯ РАБОТА № 26
- •СВЕДЕНИЯ ИЗ ТЕОРИИ
- •ПРАКТИЧЕСКАЯ ЧАСТЬ
- •ЛИТЕРАТУРА
- •СВЕДЕНИЯ ИЗ ТЕОРИИ
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •СВЕДЕНИЯ ИЗ ТЕОРИИ
- •Рис. 3. Схема измерений на лабораторной установке
- •ПРАКТИЧЕСКАЯ ЧАСТЬ
- •ОПИСАНИЕ ЛАБОРАТОРНОЙ УСТАНОВКИ
- •ПОРЯДОК ВЫПОЛНЕНИЯ И ОФОРМЛЕНИЯ РЕЗУЛЬТАТОВ РАБОТЫ
- •КОНТРОЛЬНЫЕ ВОПРОСЫ
- •ЛИТЕРАТУРА

Таблица 3
Результаты определения емкости
Время разряда (τ), ч |
UP, В |
|
|
Разряд закончить при падении напряжения на свинцовом аккумуляторе до 1,8 – 1,85 В и на щелочных до 0,9 – 1,0 В, построить график разрядной кривой (зависимость UP от τ).
Рассчитать емкость по формуле (5). Если на опытном аккумуляторе присутствует маркировка, то рассчитать величину снижения емкости от номинальной. Сделать вывод о целесообразности дальнейшего использования данного аккумулятора.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Какие электрохимические процессы протекают на отрицательном и положительном электродах свинцового и никель-кадмиевого аккумулятора: а) при разряде; б) заряде? В каком случае электроды служат катодом и в каком анодом?
2.Как измерить равновесный потенциал электродов? Почему он отличается от токового значения потенциала?
3.Какой вид имеет принципиальная электрическая схема при заряде и разряде аккумулятора?
4.Какие основные применения у свинцового аккумулятора и почему? Какие аккумуляторы целесообразней использовать в пассажирских вагонах?
5.Какие аккумуляторы не боятся хранения в разряженном состоянии, перезарядки, вибрации и почему?
|
ЛИТЕРАТУРА |
1. |
Зубрев Н.И. Инженерная химия на железнодорожном транспорте. |
– М.: УМК МПС РФ, 1990, 291 с. |
|
2. |
Варапаев Н.В., Дасоян М.А., Никольский В.А. Химические источни- |
ки тока. – М.: Высшая школа, 1990, 240 с.
54
ЛАБОРАТОРНАЯ РАБОТА №47
ИССЛЕДОВАНИЕ ПРОЦЕССА КОРРОЗИИ ПОДЗЕМНЫХ СООРУЖЕНИЙ ПОД ДЕЙСТВИЕМ БЛУЖДАЮЩЕГО ТОКА
Цель работы: изучить механизм коррозии на лабораторной установке, имитирующей возникновение блуждающего тока в условиях электрифицированного рельсового транспорта.
Рабочее задание: измерить потенциалы анодных и катодных участков на подземном сооружении и рельсах, составить потенциальные диаграммы, рассчитать среднюю скорость коррозии подземного сооружения, рельса.
СВЕДЕНИЯ ИЗ ТЕОРИИ
Электрифицированный рельсовый транспорт, (железнодорожный, трамвайный, метрополитен и т.д.) имеющий 0,25-3,3 кВ постоянного и 27,5 кВ переменного напряжения, является источником блуждающего тока.
Рельсы как рельсовая сеть используются в качестве обратного провода для возврата тяговых токов на тяговую подстанцию (ТП).
Рельсы, лежащие на шпалах и земляном балласте, ненадежно изолированы от земляного полотна, и поэтому часть тягового тока при возврате на подстанцию ответвляется и проходит по земле, как по параллельному рельсам проводнику.
Ответвление части тягового тока с рельсов в землю следует признать неизбежным и сопутствующим явлением любого вида электрифицированного рельсового транспорта.
При движении локомотива, трамвая между ними и отсасывающим проводом (ОП) ТП по рельсам протекает Iр ток, создающий падение напряжения в рельсах (Uр)
Uр= Iр *Rр = Uл – Uоп,
где Uл– потенциал рельса под локомотивом, В;
Uоп – потенциал рельса в месте контакта отсасывающего провода, В; Rр – удельное, продольное сопротивление рельсовой сети, Ом/км.
Исходя из значений rр и тяговых токов, например, для локомотива ВЛ_10, ВЛ-11 и рельсов Р-65, можно предположить, что величина Uр достигает 20-30 В/км.
При контакте рельса с земляным полотном, имеющим определенную влажность, электролитические загрязнения, примеси, т.е. имеющим определенную электропроводность, происходит параллельное ответвление тока в землю (Iз). Его путь сложен, т.к. определяется физико-химическими свойст-
55
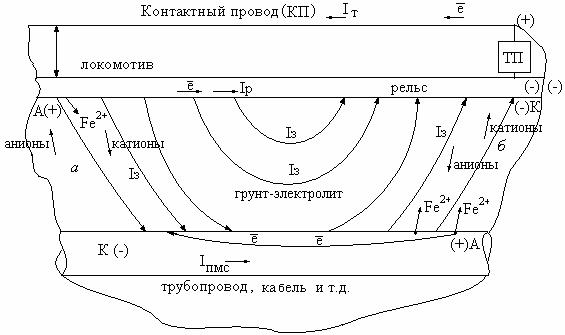
вами отдельных участков, грунта, наличием в нем подземных сооружений, коммуникаций, кабелей, трубопроводов и т.д. Поэтому этот ответвленный ток (ток утечки) получил название блуждающего (рис. 1). Место возврата его в рельсы будет также неопределено и постоянно меняться. Его величина без учета электрохимического фактора определяется соотношением между удельным продольным сопротивлением рельса (rр, Ом/км) и суммой переходного сопротивления «рельс-земля» (rр-з, Ом · км) и сопротивлением земли
(rз).
Рис. 1. Схема токов стекания блуждающих токов и электрокоррозии
ПМС
Подземные металлические сооружения, например, из стали в области блуждающих токов образуют дополнительную проводимость первого рода, тогда как влажная земля с примесями является своеобразным электролитом, т.е. ионным проводником второго рода. Часть блуждающего тока может попадать на подземное металлическое сооружение (ПМС).
Смена механизма переноса тока на границе «земля-металл» или «ме- талл-земля», т.е. переход тока через границу «металл-земля» и наоборот возможен только за счет протекания на поверхности металла гетерогенных окислительно-восстановительных, т.е. электрохимических реакций. Их скорость определяется в данном случае величиной части блуждающего тока, попавшего на сооружение (IПМС).
Таким образом, тяговый ток разветвляется на ток в рельсах и блуждающий ток. Последний разветвляется на ток, проходящий по земле (Iз), и ток, проходящий по подземному металлическому сооружению (IПМС), вызывающий электрокоррозию подземного металлического сооружения.
56

При рассмотрении механизма электрокоррозии ПМС под действием блуждающего тока необходимо выделить электрохимические цепи (рис. 1):
а) рельс – земля – сооружение; б) сооружение – земля – рельс.
Рис. 2. Эквивалентная электрическая схема процесса электрокоррозии
При контакте металл – электролит (земля) при отсутствии поляризации током образуется стационарный электрохимический потенциал Ест (В), или потенциал коррозии, по своей величине расположенный между потенциалами анодной и катодной реакции.
Участок выхода тока из рельса в земляное полотно оказывается подсоединенным через локомотив к положительному полюсу ТП и является анодом, т.е. имеет потенциал Еа более положительный, чем Ест.
Противоположный ему участок поверхности подземного сооружения, коммуникации, т.е. место входа блуждающего тока (IПМС), оказывается подсоединенным через участок «б» к отрицательному полюсу ТП, и является катодом. Он имеет потенциал Ек с более отрицательным значением, чем Ест.пмс.
Место выхода блуждающего тока IПМС с поверхности сооружения через участок (а) подсоединено к положительному полюсу ТП, поэтому является анодом с более положительным потенциалом, чем Ест.
Противоположный месту выхода IПМС участок рельса, место возврата блуждающего тока, является отрицательно заряженным электродомкатодом.
Фактически, в системе «рельс – земля - металлическое сооружение» под действием блуждающего тока с напряжение Uр происходит электролиз с биполярными электродами, с растворимым анодом.
Растворимыми анодными участками являются места выхода блуждающего тока с рельса и из сооружения в землю. Металл на них подвергается электрохимическому окислению и растворению по реакции для стали
2+ |
0 |
= −0,44В |
(1) |
А (+) Fe – 2e → Fe |
, ЕFe2 + / Fe |
Атом железа отдает два электрона и в виде иона Fe2+ переходит в коррозионную среду, в почву или остается на поверхности, образуя первичные
57
продукты коррозии Fe(ОН)2. Далее, под действием кислорода воздуха и воды в почве происходит дальнейшее окисление двухвалентного железа до трехва-
лентного гидроксида железа Fe(OH)3 |
|
4Fe(ОН)2 + O2 + 2 H2О → 4Fe(OH)3 . |
(2) |
Со временем красно-коричневый гидроксид железа (III) превращается в гидратированный оксид железа (III) переменного состава – ржавчину
хFe2O3 · y H2O.
Как для большинства химических реакций, для электрохимической также существует энергетический барьер, преодоление которого требует некоторой поляризации; отклонение потенциала Е в отрицательную сторону для катодной реакции от Ест и отклонение в положительную сторону для анодной реакции. Поэтому в первую очередь на электродах протекают реакции, требующие наименьшее количество энергозатрат. Такой реакцией на аноде является рассмотренная реакция 1, которая может протекать самопроизвольно. Освободившиеся при анодной реакции электроны переходят под действием электрического поля (рис. 1) на катод, где они расходуются на реакцию восстановления.
На катодных участках возможно протекание нескольких реакций в следующей последовательности:
1. Восстановление молекул кислорода с образованием гидроксогрупп
К (-) О2 + 4e +2H2O → 4OH-. |
(3) |
Эта реакция также может протекать самопроизвольно, без значительных энергозатрат на поверхности металла, т.к. ее потенциал весьма положителен ( в стандартных условиях ЕО0 2 / 4ОН− = + 0,40 В для железа).
Поэтому реакции 1 и 3 протекают быстро при незначительной поляризации.
2. В кислой среде происходит восстановление ионов водорода
К (-) 2Н+ + 2e → Н2↑. |
(4) |
В стандартных условиях РН2 = 101,3 кПа, t = 250С, потенциал этой реакции Е0 = 0,0 В.
3.В нейтральной и щелочной средах возможно восстановление молекул воды
К (-) 2Н2О + 2е → Н2↑ + 2ОН- (Е0 = - 0,41 В). |
(5) |
58
