
- •1 Теоретические пояснения
- •Химические свойства
- •1.2 Алкены
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов.В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
- •1. Получение бензола из ацетилена:
- •1. Взаимодействие с щелочными металлами:
- •Химические свойства фенолов
- •3. В технике альдегиды получают прямым присоединением со и н2 к олефинам:
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •2. Оксосинтез:
- •4. Гидролиз тригалогенпроизводных:
- •Химические свойства
6. Взаимодействие с аммиаком:

Альдимины легко полимеризуются в циклические альдегидаммиаки, используемые как ускорители вулканизации каучуков:

Взаимодействием формальдегида с аммиаком получают уротропин:
6 НСОН + 4NH3 (CH2)6N4 + 6H2O
7. Образование оксимов с гидроксиламином:
R – CH = O + H2N-OH H2O + R-CH = NOH
альдоксим
R2C = O + H2N-OH R2C = N – OH + Н2О
кетоксим
Эти реакции применяют для количественного определения карбонильных соединений, используя солянокислый гидроксиламин.
8. Взаимодействие с гидразином и его замещенными.В зависимости от условий гидразин образует гидразоны:


или азины (альдазины и кетазины):

9. Реакции полимеризации альдегидов в присутствии следов минеральных кислот.При этом формальдегид может превращаться в параформ:
nСН2О (-CН2О-)n
со степенью полимеризации n=8-10, полиформальдегид со степенью полимеризацииn=1000, циклический продукт – триоксиметилен:

Полимеризация уксусного альдегида приводит к образованию паральдегида:

паральдегид
10. Реакции конденсации альдегидов, приводящие к образованию альдолей, называют альдольной конденсацией (а).Конденсация, сопровождающаяся отщеплением воды и образованием непредельного альдегида, называетсякротоновой конденсацией (б).Альдольная конденсация кетонов протекает в более жестких условиях с образованием-кетоноспиртов (в):
а) СН3СНО + НСН2СОН СН3СН(ОН)СН2СНО
3-оксибутаналь (альдоль)
б
-H2O
кротоновый альдегид
в) (СН3)2С=О+НСН2-СО-СН3(СН3)2С(ОН)-СН2-СО-СН3(СН3)2С=СН-СО-СН3
-H2O
(4-окси-4-метилпентанон-2) (4-метилпентен-3-он-2)
Из соединений, участвующих в ключевой стадии при альдольной конденсации, одно должно быть донором пары электронов, а другое – акцептором.
Альдегиды, не способные к альдольной конденсации, вступают в реакцию Канниццаро (реакция дисмутации альдегидов):
2 (СН3)2СНСНО + КОН (СН3)2СНСООК + (СН3)2СНСН2ОН
11. Сложноэфирная конденсация (по Тищенко) в присутствии алкоголятов алюминия приводит к получению из ацетальдегида этилацетата:
СН3СНО + СН3СНО СН3СООС2Н5
12. Получение пентаэритрита (щелочной катализ):
СН3СНО + 3СН2О С (СН2ОН)4
13. Замещение карбонильного кислорода хлором при действии РCI5 позволяет получить геминальные дигалогенпроизводные:
R2C=О + РСI5 R2CCI2 + POCI3
14.Карбонильная группа оказывает активирующее действие на реакционную способность связанных с ней углеродных атомов(особенно-атомов), вследствие чегодля альдегидов и кетоновхарактерны реакции замещения в углеводородном радикале:
СН3СН2СНО + CI2 CH3CHCICHO
Реакции отличаются от реакций галогенирования алканов тем, что протекают в присутствии кислых или щелочных катализаторов.
При пропускании хлора через ацетальдегид получается 2,2,2-трихлорацетальдегид (хлораль) –CI3-CH=O, который широко используется в органическом синтезе.
15. Галоформная реакция,индуцируемая основаниями, приводит к получению галоидпроизводных типаСНHaI3и может служить качественной реакцией на метилкетоны .

Образующийся тригалогенкетон легко атакуется основанием, что приводит к расщеплению С-С связи:

Образование иодоформа (осадок в виде желтых кристаллов) является качественной реакцией на группу СН3СО-.
16. Реакции окисления. Альдегиды окисляются до карбоновых кислот даже такими слабыми окислителями, как аммиачный раствор оксида серебра (реактив Толленса). Эта качественная реакция на альдегиды известна под названием “реакции серебряного зеркала”:
RCOH + 2Ag(NH3)2OH RCOONH4 + 2Ag + 3NH3 + H2O
Альдегиды окисляются также феллинговой жидкостью (“реакция медного зеркала”).
Кетоны окисляются труднее. Они более устойчивы к слабым окислителям и к кислороду воздуха. При действии сильных окислителей происходит разрыв углеродной цепи и образование смеси кислот. При окислении симметричных кетонов образуется не более двух кислот:
О
СН3-СН2-СО-СН2-СН3 СН3-СН2-СООН + СН3СООН
Карбоновые кислоты
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп - СООН.
Карбоновые кислоты классифицируют по числу карбоксильных групп (одноосновные и многоосновные), по количеству атомов углерода (низшие и высшие), в зависимости от строения углеводородного радикала (предельные, непредельные, ароматические, оксикислоты, фенолокислоты, альдегидо- и кетокислоты и другие группы). В соответствии с вышеуказанным различают следующие гомологические ряды карбоновых кислот.
|
Предельные одноосновные кислоты |
Непредельные одноосновные кислоты | ||
|
НСООН |
муравьиная |
СН2=СН-СООН |
Акриловая |
|
СН3СООН |
уксусная |
СН2=СН-СН2-СООН |
Винилуксусная |
|
СН3СН2СООН |
пропионовая |
СН3СН=СНСООН |
кротоновая
|
|
СН3(СН2)2-СООН |
масляная |
СН2=С(СН3)-СООН |
метакриловая |
|
СН3(СН2)3-СООН |
валериановая |
СН3-(СН=СН)2-СООН |
сорбиновая |
|
СН3(СН2)4-СООН |
капроновая |
СН3(СН2)7СН=СН(СН2)7-СООН |
Олеиновая (цис-), элаидиновая (транс-) |
|
СН3(СН2)5-СООН |
энантовая |
С17Н31СООН |
линолевая |
|
СН3(СН2)10-СООН |
лауриновая |
С17Н29СООН |
Линоленовая |
|
СН3(СН2)14-СООН |
пальмитиновая |
СН=С-СООН |
Пропиоловая |
|
СН3(СН2)16-СООН |
стеариновая |
СН3С=С-СООН |
тетроловая |
|
С20Н31СООН |
арахидоновая |
|
|
Предельные двухосновные кислоты: НООС-СООН – щавелевая, НООС-СН2-СООН – малоновая, НООС-(СН2)2-СООН – янтарная, НООС-(СН2)3-СООН – глутаровая, НООС-(СН2)4-СООН – адипиновая, НООС-(СН2)5-СООН – пимелиновая, НООС-(СН2)6-СООН – пробковая, НООС-(СН2)7- СООН – азелаиновая, НООС-(СН2)8-СООН – себациновая.
Непредельные двухосновные кислоты: НООС-СН=СН-СООН – малеиновая (цис-изомер) и фумаровая (транс-изомер).
Ароматические карбоновые кислоты: одноосновные – С6Н5-СООН –бензойная; СН3-С6Н4-СООН – толуиловые кислоты (орто-, мета-, пара-), двухосновные:
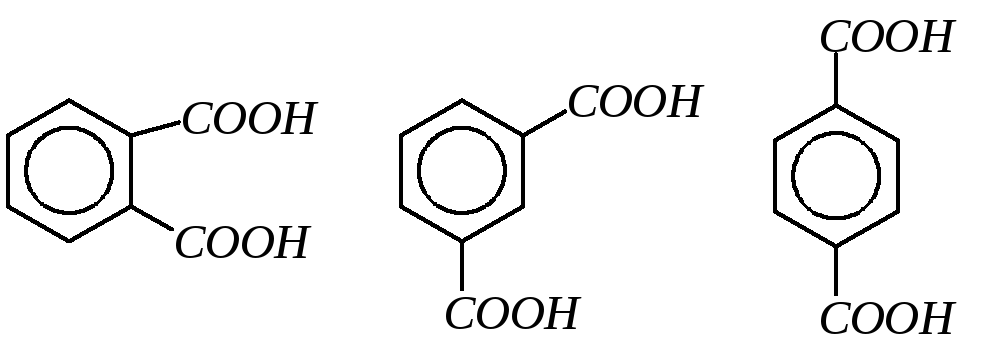
фталевая изофталевая терефталевая
Предельные жирно-ароматические кислоты: С6Н5-СН2-СООН – фенилуксусная.
Непредельные жирно-ароматические кислоты: С6Н5-СН=СН-СООН – коричная
Оксикарбоновые кислоты: одноосновные:НО-СООН– оксимуравьиная, угольная;НО-СН2-СООН– гликолевая;СН3СН(ОН)-СООН– молочная; двухосновные:НООС-СНОН-СООН– тартроновая,НООС-СН2-СНОН-СООН– яблочная,НООС-СНОН-СНОН-СООН– винная;
НООС-СН2-С(ОН)(СООН)-СН2-СООН– лимонная; ароматические оксикислоты (фенолокислоты):

салициловая о-оксикоричная
Методы получения
Карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная кислота – в крапиве, яблочная – в фруктах, сорбиновая – в ягодах рябины, брусники, изовалериановая – в валериановом корне), а также в виде сложных эфиров и жиров. Основным источником получения карбоновых кислот является все же органический синтез.
1. Окисление спиртов, альдегидов, кетонов, углеводородов (см. химические свойства указанных соединений).
