
- •1 Теоретические пояснения
- •Химические свойства
- •1.2 Алкены
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов.В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
- •1. Получение бензола из ацетилена:
- •1. Взаимодействие с щелочными металлами:
- •Химические свойства фенолов
- •3. В технике альдегиды получают прямым присоединением со и н2 к олефинам:
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •2. Оксосинтез:
- •4. Гидролиз тригалогенпроизводных:
- •Химические свойства
Химические свойства фенолов
Большинство фенолов – бесцветные твердые вещества. Простейший фенол C6H5OH обладает характерным запахом, плавится при 42оС. Температура плавления фенола сильно понижается от примеси небольших количеств воды (кристаллогидратC6H5OH•H2Oплавится при 16оС). Фенол гигроскопичен, кристаллы его при стоянии на воздухе расплываются. Раствор фенола в воде обладает антисептическими свойствами. Пары фенола токсичны, а сам он вызывает ожоги кожи.
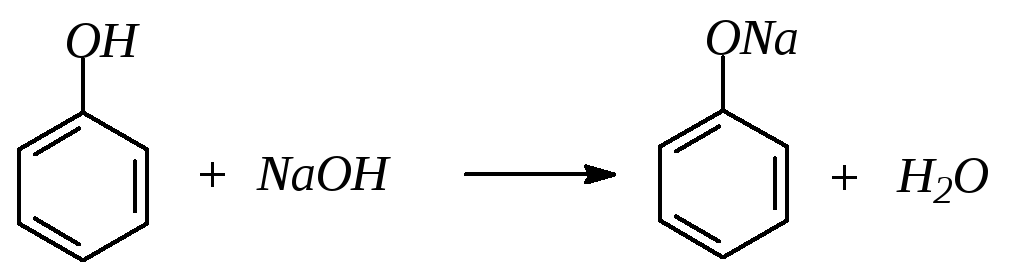
1. Проявляя кислотные свойства, фенол реагирует с гидроксидом натрия, образуя феноляты:
2.Фенолы легко алкилируютсяпри действии на феноляты галогенпроизводных, особенно в присутствии порошка меди, а также при действии на фенол алкилсульфатов, эфиров сульфокислот или диазометана:

3. Фенол конденсируется с окисью этилена с образованием фенилового эфира полиэтиленгликоля:

4. фенолы не этерифицируются непосредственно карбоновыми кислотами. Эфиры фенолов могут быть получены действием ангидридов или галогенангидридов кислот на феноляты или растворы фенолов в пиридине:
![]()
5. Гидроксильная группа в фенолах с большим трудом замещается на галоген:
![]()
6. При перегонке фенолов с цинковой пылью гидроксильная группа замещается на водород:
![]()
7. Галогенирование фенола действием растворов галогенов или галогенирующих средств идет с большой скоростью и преимущественно впара-положение. Конечным продуктом галогенирования в ядро являются тригалогенофенолы. Возможно дальнейшее галогенирование:

8. Нитрование фенола идет уже при действии разбавленной азотной кислоты. При дальнейшем нитровании концентрированной азотной кислотой получается тринитрофенол – пикриновая кислота:

9. При сульфировании фенолов получаются о- и п-фенолсульфокислоты:

10. Фенолы легко конденсируются с альдегидами:
а) при действии щелочных или кислых катализаторов на смесь фенола и какого-либо альдегида жирного ряда происходит конденсация в о-ип-положениях при обычной температуре рост молекулы за счет конденсации фенола с альдегидом идет в линейном направлении:

11. При действии на фенол перекиси водородав присутствии железного катализатора получается с небольшим выходом пирокатехин:

При действии на фенол хромовой смесью образуется п-бензохинон и продукты его дальнейших изменений:

12. При гидрировании водородом в присутствии катализаторафенолы превращаются в спирты ряда циклогексана:

Альдегиды и кетоны
Альдегидами и кетонами называют производные углеводородов общей формулыСnH2nO, содержащие карбонильную (оксо-) группуС=О.
В альдегидах она связана с радикалом и водородом R-CН =O, в кетонах с двумя радикаламиR2C=O. В зависимостиот углеводородного радикаларазличаютпредельные НСОН– формальдегид,СН3СОН– ацетальдегид,СН3СОСН3– ацетон,непредельные СН2=СНСОН– акролеин,СН3-СН=СНСОН– кротоновый альдегид, ароматическиеС6Н5СОН– бензальдегид,СН3-С6Н4-СОН– толуиловыеальдегиды.Диальдегиды и дикетонысодержатдве оксогруппы:СНОСНО– глиоксалевый альдегид,СНОСН2СНО– малоновый альдегид,СН3-СО-СО-СН3– диацетил, бутандион (-дикетон),СН3-СО-СН2-СО-СН3–ацетилацетон, пентандион-2,4 (-дикетон). Альдегиды и кетоны являются изомерами.Изомерия альдегидов и кетонов связана со строением углеродного скелета радикала, у кетонов она также определяется положением карбонильной группы.
Методы получения
1. Альдегиды и кетоны удобно получать пиролизом кислот и их смесей в виде паров над оксидами некоторых металлов (оксидом марганца, оксидом цинка) при 400-4500С:



2. Гидратация ацетилена и его гомологов в условиях реакции Кучерова приводит соответственно к уксусному альдегиду и кетонам:


