
- •1 Теоретические пояснения
- •Химические свойства
- •1.2 Алкены
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов.В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
- •1. Получение бензола из ацетилена:
- •1. Взаимодействие с щелочными металлами:
- •Химические свойства фенолов
- •3. В технике альдегиды получают прямым присоединением со и н2 к олефинам:
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •2. Оксосинтез:
- •4. Гидролиз тригалогенпроизводных:
- •Химические свойства
1. Получение бензола из ацетилена:
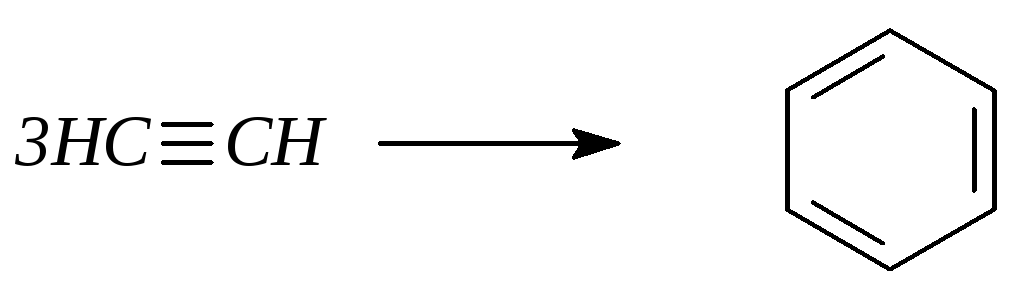
2. Дегидрирование циклоалканов:
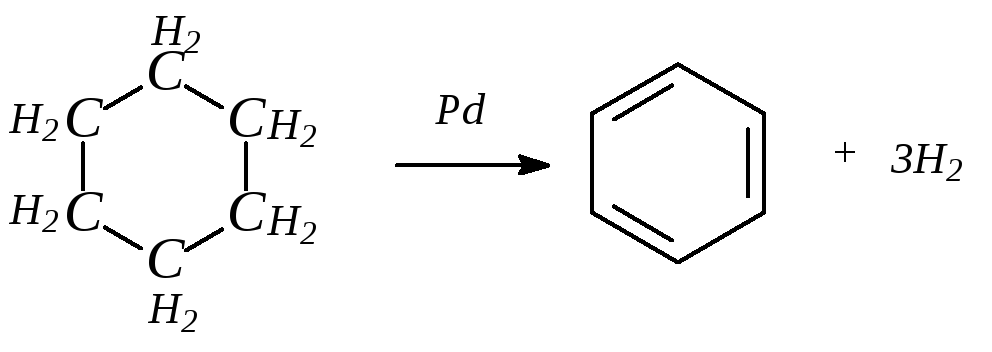
3. Из ароматических соединений:

4. Гомологи бензола получают из галогенпроизводных реакцией Вюрца-Фиттига:

Химические свойства
Особенности ароматических соединений. Бензол является первым представителем ароматических углеводородов. Он обладает рядом своеобразных свойств, отличающих его от изученных ранее предельных и непредельных ациклических углеводородов. Ароматический характер бензола определяется его строением и проявляется в химических свойствах.
Состав бензола выражается формулой C6H6. Общая формула гомологов ряда бензола CnH2n-6. Разность между этой формулой и формулой ряда предельных углеводородов CnH2n+2 равна 8Н. Следовательно, по химическому составу бензол и его гомологи являются непредельными соединениями. Их непредельный характер не проявляется в типичных реакциях. Для данных соединений, в основном, характерны реакции замещения, однако они могут вступать и вреакции присоединения.
А. Реакции замещения
1. Взаимодействие с галогенами. В присутствии катализаторов — кислот Льюиса (FeCl3, АlСl3) хлор и бром замещают атомы водорода в молекуле бензола:

2. Взаимодействие с серной кислотой.Концентрированная серная кислота не вызывает полимеризации бензола, как это происходит в случае алкадиенов, а приводит к получению бензолсульфокислоты:

3. Нитрование. При действии нитрующей смеси (концентрированные НNO3 и H2SO4) происходит нитрование ядра (введение в ядро нитрогруппы -NO2) с образованием нитропроизводных бензола.
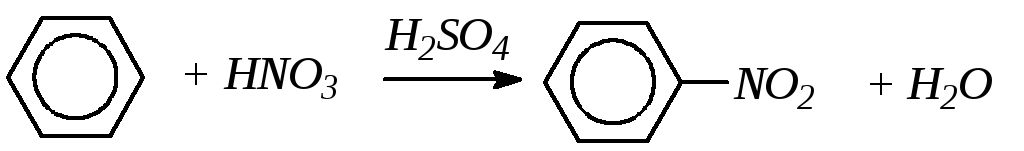
Нитробензол
4. Замещение водорода на галоген. Реакция протекает в присутствии солей железа (III).

Б. Реакции присоединения
В отдельных редких случаях бензол способен к реакциям присоединения.
1. Гидрирование, т. е. присоединение водорода, происходит при действии водорода в жестких условиях в присутствии катализаторов (Ni, Pt, Pd). При этом молекула бензола присоединяет три молекулы водорода с образованием циклогексана:

циклогексан
2. Присоединение галогенов. Если раствор хлора или брома в бензоле подвергнуть действию солнечного света или ультрафиолетовых лучей, то происходит радикальное присоединение трех молекул галогена с образованием сложной смеси стереоизомеров гексахлорциклогексана (гексахлорана):
hυ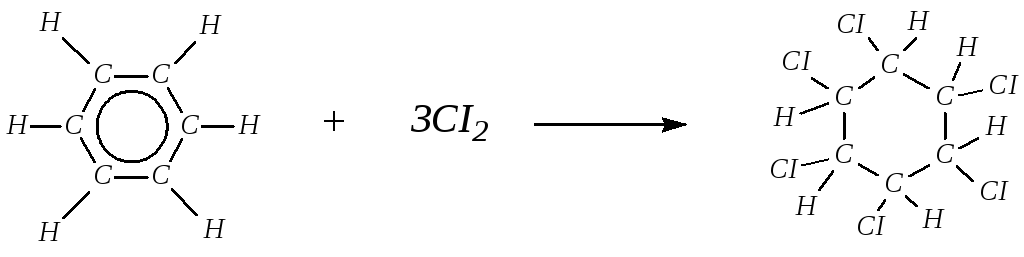
Таким образом, ароматический характер бензола (и других аренов) выражается в том, что это соединение, по составу являясь непредельным, в целом ряде химических реакций проявляет себя как предельное соединение; для него характерны химическая устойчивость, трудность реакций присоединения. Только в особых условиях (катализаторы, облучение) бензол ведет себя как триеновый углеводород.
Спирты и фенолы
Гидроксисоединения (R-OH), в которых гидроксильная группа связана с насыщенным атомом углерода (т.е. с sp3-гибридизованным атомом), называются спиртами (первичными – RCH2OH, вторичными – R2CHOH, третичными – R3COH).
В зависимости от числа гидроксогрупп различают одноатомные имногоатомные спирты, по характеру углеводородного радикала –предельные, непредельные, ароматические спирты, по количеству углеродных атомов –низшие (С1 – С10) и высшие (С11 и более).
Методы получения спиртов
Спирты в свободном состоянии в природе встречаются редко, поэтому их получают синтетическими методами. Основные промышленные методы получения спиртов следующие.
1. Каталитическая гидратация алкеновиспользуется для получения этанола и других спиртов:
СН2 = СН2 + Н2О С2Н5ОН
Условия реакции: этилен и водяной пар при 70-80 ат и 280-300оС пропускают над фосфорной кислотой, нанесенной на кремнезем (прямая гидратация) или используют в качестве катализатора серную кислоту (непрямая гидратация).
2.Ферментативный методиспользуется для получения спиртных напитков и состоит в брожении сахаристых веществ:
Дрожжи
С6Н12О6 2 С2Н5ОН + 2 СО2
3.Синтез метанолаосуществляют из природного газа:
СН4 + Н2О СО + 3Н2(Ni;50-100ат;900оС)
2Н2 + СО СН3ОН(Cr2O3+ZnO; 50-100ат; 400оС)
4. Гидролиз моногалогенпроизводных(получение пентиловых спиртов):
R-CH2CI + NaOH(водный) R-CH2OH + NaCI
5. Лабораторные методыполучения спиртов основаны на реакциях гидролиза галогеналканов и сложных эфиров, а также гидратации алкенов и восстановлении карбонильных соединений.
Химические свойства спиртов
Спирты проявляют следующие наиболее характерные химические свойства.
