
- •1 Теоретические пояснения
- •Химические свойства
- •1.2 Алкены
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов.В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
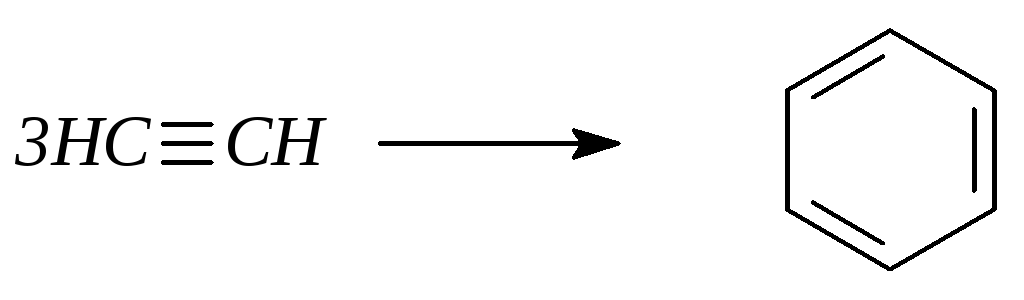
- •1. Получение бензола из ацетилена:
- •1. Взаимодействие с щелочными металлами:
- •Химические свойства фенолов
- •3. В технике альдегиды получают прямым присоединением со и н2 к олефинам:
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •2. Оксосинтез:
- •4. Гидролиз тригалогенпроизводных:
- •Химические свойства
Химические свойства
В молекулах алкинов
атом углерода находится в sp-гибридизации,
следовательно молекулы алкинов имеют
линейное строение, а между атомами
углерода имеется тройная –С
С– связь,
состоящая из двух
![]() -
и одной
-
и одной![]() -связи.
-связи.
Все реакции
присоединения, свойственные алкенам,
наблюдаются и у алкинов. Однако, у алкинов
после присоединения первой молекулы
реагента остается еще одна
![]() -связь
(алкин превратился в алкен), которая
снова может вступить в реакцию
присоединения второй молекулы реагента.
-связь
(алкин превратился в алкен), которая
снова может вступить в реакцию
присоединения второй молекулы реагента.
Другой особенностью
алкинов является наличие у некоторых
из них, так называемого, ацетиленового
атома водорода (![]() С-Н).
С-Н).
![]() -связь
образованнаяs—орбиталью
атома водорода и sp-орбиталью
атома С. В орбитали sp
по сравнению с орбиталями sp2
и
sp3
доля s-орбитали
значительно выше – соответственно 50,
33 и 25% .
-связь
образованнаяs—орбиталью
атома водорода и sp-орбиталью
атома С. В орбитали sp
по сравнению с орбиталями sp2
и
sp3
доля s-орбитали
значительно выше – соответственно 50,
33 и 25% .
Так как s-электроны
находятся ближе к ядру, чем соответствующие
p-электроны,
то электроны sp-орбитали
значительно прочнее связаны с ядром,
чем электроны sp2
и тем более sp3-орбиталей.
Поэтому электронная пара связи
![]() С—Н
сильно «оттянута» в сторону атома
углерода (
С—Н
сильно «оттянута» в сторону атома
углерода (![]() C
C![]() Н)
и следует ожидать более легкого
гетеролитического разрыва этой связи
с отщеплением протона Н+,
т. е. проявления у незамещенных алкинов
кислотных свойств.
Н)
и следует ожидать более легкого
гетеролитического разрыва этой связи
с отщеплением протона Н+,
т. е. проявления у незамещенных алкинов
кислотных свойств.
Это действительно происходит, хотя и в значительно меньшей степени, чем для кислот обычного типа. Поэтому для алкинов, имеющих ацетиленовый атом водорода, следует помимо реакций присоединения по тройной связи ожидать и реакций замещения этого атома водорода на другие группы.
А. Реакции присоединения
1. Присоединение водорода. При последовательном присоединении одной молекулы водорода к тройной связи получается соответствующий алкен, а в последствии и алкан:
НС![]() СН
+ H2
СН
+ H2
![]() H2C=CH2
+
H2
H2C=CH2
+
H2
![]() H3C-CH3
H3C-CH3
Реакция легко идет над катализаторами (Рd, Pt или Ni).
2. Присоединение галогенов. Галогены также присоединяются к тройной связи с образованием или двузамещенного галогенпроизводного этиленового углеводорода (присоединение одной молекулы галогена), или четырехзамещенных галогенпроизводных алкана.

3. Присоединение галогеноводородов. Присоединение одной молекулы галогеноводорода к алкинам приводит к образованию моногалогенпроизводных алкенов. Присоединение второй молекулы галогеноводорода приводит к образованию геминальных дигалогенпроизводных алканов (в соответствии с правилом Марковникова):

4. Присоединение воды. Вода присоединяется к ацетиленовым углеводородам под действием разных катализаторов, но особенно легко в присутствии солей ртути (II) в сернокислом растворе (Кучеров,1881 год). При этом из ацетилена получается уксусный альдегид, а из гомологов ацетилена - кетоны. На первой стадии присоединение воды происходит в соответствии с правилом Марковникова, с образованием неустойчивого винилового спирта. Последний перегруппировывается в соответствующий кетон (в случае ацетилена - ацетальдегид):


5. Присоединение спиртов.В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:

6. Присоединение карбоновых кислот. Уксусная кислота присоединяется к ацетилену в присутствии ортофосфорной кислоты с образованием винилацетата – мономера для синтеза поливинилацетата (ПВА).

7. Присоединение синильной кислоты. При совместном каталитическом действии Сu2Cl2 и NH3 к ацетилену можно присоединить синильную кислоту с образованием акрилонитрила, применяющегося в производстве синтетических каучуков:
НС![]() СН
+ HCN
СН
+ HCN![]() H2C=CH-C
H2C=CH-C![]() N
N
8. Реакции димеризации и тримеризации. При каталитической димеризации ацетилена (Сu2Cl2 и NH4Cl) образуется винилацетилен, а при тримеризации – бензол.
![]()
Б. Реакции ацетиленового атома водорода
При соответствующих условиях атом водорода, находящийся у тройной связи, способен замещаться на атомы металлов. При этом образуются ацетилениды соответствующих металлов:
R-C![]() CH
+ NaNH2
CH
+ NaNH2
![]() R-C
R-C![]() C-Na
+ NH3
C-Na
+ NH3
R-C![]() CH
+ [Ag(NH3)2]OH
CH
+ [Ag(NH3)2]OH
![]() R-C
R-C![]() C-Аg
+ H2O
+ 2NH3
C-Аg
+ H2O
+ 2NH3
Ароматические углеводороды (арены)
Методы получения
В значительном количестве углеводороды ряда бензола содержатся в некоторых сортах нефти, откуда их и получают при переработке нефти. Помимо этого, так как ядро бензола энергетически очень «выгодная» система, соединения ароматического ряда образуются при многих процессах. Так, например, при каталитическом и термическом крекинге нефти, даже не содержащих ароматических соединений, они образуются в заметном количестве вследствие превращений других углеводородов.
При переработке каменного угля в кокс в отгоняющемся каменноугольном дегте содержание соединений ароматического ряда достигает нескольких десятков процентов.
В лабораторной практике и в промышленности для синтеза замещенных аренов широко применяется синтез Фриделя - Крафтса (реакции алкилирования ароматических углеводородов в присутствии кислот Льюиса).
