
- •1 Теоретические пояснения
- •Химические свойства
- •1.2 Алкены
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов.В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
- •1. Получение бензола из ацетилена:
- •1. Взаимодействие с щелочными металлами:
- •Химические свойства фенолов
- •3. В технике альдегиды получают прямым присоединением со и н2 к олефинам:
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •2. Оксосинтез:
- •4. Гидролиз тригалогенпроизводных:
- •Химические свойства
1.2 Алкены
Методы получения
1. При действии спиртовых растворов щелочей на галогенпроизводные отщепляется галогенводород и образуется двойная связь:
СН3-СН2-CH2Br![]() СН3-СН2=CH2
+ NaBr
+ H2O
СН3-СН2=CH2
+ NaBr
+ H2O
Если в
![]() -положениик
атому углерода, связанному с галогеном,
находятся третичный, вторичный и
первичный атомы водорода, то преимущественно
отщепляется третичный атом водорода,
в меньшей степени вторичный и тем более
первичный (правило Зайцева).
-положениик
атому углерода, связанному с галогеном,
находятся третичный, вторичный и
первичный атомы водорода, то преимущественно
отщепляется третичный атом водорода,
в меньшей степени вторичный и тем более
первичный (правило Зайцева).
KOH
(спирт)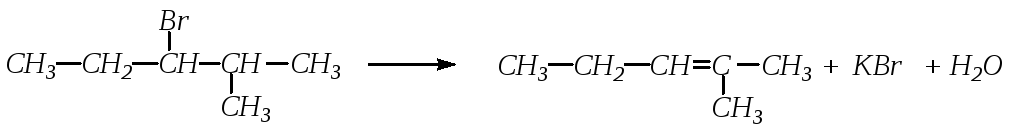
2. Действием на спирты водоотнимающих средств:

При действии Zn или Мg на дигалогенпроизводные с двумя атомами галогена у соседних атомов углерода:

4. Гидрированием ацетиленовых углеводородов над катализаторами:
![]()
5. Алкены в виде сложных смесей получаются при крекинге нефти

Химические свойства
Наличие в молекулах
алкенов двойной связи, состоящей из
![]() -
и
-
и![]() -
связей, предопределяет их повышенную
реакционную способность в реакциях
присоединения, так как
-
связей, предопределяет их повышенную
реакционную способность в реакциях
присоединения, так как![]() -связь
прочнее чем
-связь
прочнее чем![]() связь.
связь.
Естественно ожидать, что реакции алкенов будут проходить по двойной связи, а следовательно, будут реакциями присоединения, а не реакциями замещения, характерными для ранее рассмотренных алканов.
1. Присоединение водорода. Присоединение водорода к алкенам приводит к образованию предельных углеводородов:
СН3-СН=CH2
+ Н2
![]() СН3-СН2-CH3
СН3-СН2-CH3
2. Присоединение галогенов. Галогены присоединяются к алкенам с образованием вицинальных дигалогенпроизводных, т. е. содержащих атомы галогена у соседних атомов углерода.

3. Присоединение галогенводородов. Галогенводороды присоединяются к алкенам с образованием галогеналкилов. Присоединение в случае несимметричных молекул идет по правилу Марковникова, т. е. водород присоединяется к наиболее гидрогенизированному атому углерода (с наибольшим числом водородных атомов):

4. Присоединение воды и серной кислоты. В присутствии кислот вода присоединяется по двойной связи в соответствии с правилом Марковникова:
R-CH=CН2
+ H2О
![]() R-CH-CН3
R-CH-CН3
│
ОН
Так же идет и реакция с серной кислотой:
R-CH=CН2
+ H2SО4
![]() R-CH-CН3
R-CH-CН3
│
OSО3H
5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
3R-CH=CH-R
+ 2KMnO4
+
4H2O
![]() 3R-CH – CH–R+ 2KOH + 2MnO2
3R-CH – CH–R+ 2KOH + 2MnO2
│ │
OH
OH
Кислые растворы перманганата окисляют алкены с разрывом цепи по С=С связи с образованием кислот или кетонов:
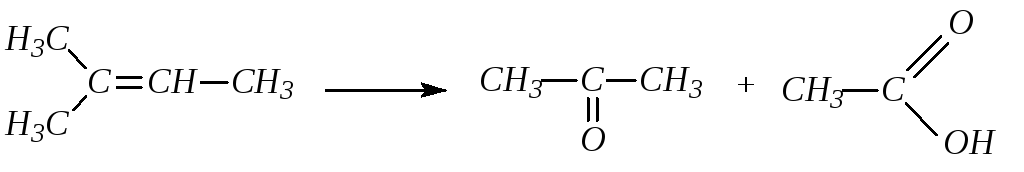
6. Действие озона на алкены. Действие озона на алкены приводит к образованию кристаллических сильно взрывчатых озонидов, которые при гидролизе образуют альдегиды или кетоны:

Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
7. Полимеризация алкенов. Большое значение получила полимеризация этилена и пропилена в полимеры с молекулярной массой около 105. До 1953 г. в основном применялась радикальная (инициируемая свободными радикалами) полимеризация, однако после, работ Циглера и Натта используют ионную полимеризацию (инициируемую ионами). Процесс полимеризации проводят в присутствии катализатора (триэтилалюминия или тетрахлортитана):
nCH2=CH2
![]() -(СН2-СН2
)n-
-(СН2-СН2
)n-
Полиэтилен, получаемый этим способом, представляет coбoй предельный углеводород с неразветвленной цепью. Благодаря сочетанию многих ценных свойств полиэтилен имеет очень широкое применение. Он является одним из лучших материалов для изоляции кабелей, применяется в радарной технике, радиотехнике, сельском хозяйстве и др. Из него изготавливают трубы, шланги, сосуды, тару для сельскохозяйственных продуктов и удобрений, пленки различной толщины и многие бытовые предметы.
Алкины
Методы получения
Наиболее общим способом получения ацетиленовых углеводородов является действие спиртового раствора щелочей на дигалогенпроизводные предельных углеводородов с вицинальным (а) или геминальным (б) расположением атомов галогена
а)
б)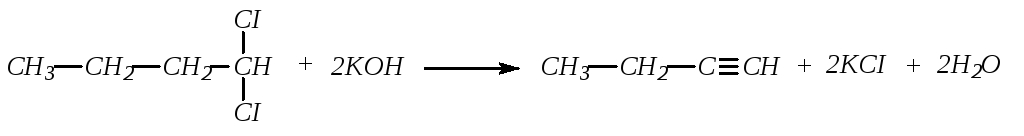
Так как вицинальные дигалогенпроизводные обычно получают присоединением галогенов к этиленовым углеводородам, то реакцию (а) можно рассматривать как реакцию превращения этиленовых углеводородов в ацетиленовые.
Геминальные дигалогенпроизводные (оба атома галогена у одного атома углерода) являются производными кетонов или альдегидов и, следовательно, с помощью реакций (б) можно осуществить переход от карбонильных соединений к алкинам. При отщеплении галогеноводородов действует правило Зайцева: водород отщепляется от углеродного атома, содержащего меньшее количество атомов водорода.
Ацетилен можно получать непосредственно при высокотемпературном крекинге (термическом или электротермическом) метана или более сложных углеводородов:
2СН4
![]() Н-С
Н-С![]() С-Н
+ ЗН2
С-Н
+ ЗН2
а так же при гидролизе карбида кальция – продукта высокотемпературного взаимодействия оксида кальция и углерода:
СаСО3
![]() СаО + СО2
СаО + СО2
СаО +3С
![]() CаC2
+ СО
CаC2
+ СО
CаC2
+ Н2О
![]() СН
СН![]() СН
+ Са(ОН)2
СН
+ Са(ОН)2
