
- •Тема 1: химия как наука и её значение в жизни человека
- •Тема 2: периодический закон и периодическая система химических элементов д.И. Менделеева
- •Большие и малые периоды
- •Тема 3: строение атома. Ядерные превращения
- •Тема 4: строение электронной оболочки атомов
- •Тема 5: периодическое изменение свойств химических элементов
- •Оэо по Полингу
- •Тема 6: химическая связь и строение молекул (I часть)
- •Энергии (Есв) и длины (св) галогеноводородных соединений
- •Заключение по материалу «Химическая связь и строение молекул»
- •Тема 8: межмолекулярное взаимодействие
- •Тема 9: основные закономерности протекания химических процессов
- •Тема 10: направленность химических реакций
- •Тема 12: электрохимические процессы
- •Тема 13: электролиз
- •Основные понятие и особенности электролиза.
- •Отдельные примеры электролиза растворов и расплавов солей.
- •Применение электролиза
- •Закон Фарадея. Решение задач.
- •Тема 14: химия металлов и электротехнические материалы Металлическое состояние вещества
- •Тема 14: химия металлов и электротехнические материалы Физические свойства металлов
- •Тема 14: химия металлов и электротехнические материалы химические свойства металлов
- •Взаимодействие металлов с кислотами
- •Действие хлороводородной кислоты на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Тема 14: химия металлов и электротехнические материалы способы получения металлов
- •Получение металлов
- •Тема 14: химия металлов и электротехнические материалы зонная теория внутреннего строения металлов
- •I. Теория электронного газа.
- •II. Зонная теория кристаллов.
- •Выводы:
- •Тема 14: химия металлов и электротехнические материалы электротехнические материалы.
- •Сверхпроводники
Оэо по Полингу
|
Элемент |
Li |
Be |
B |
C |
N |
O |
F |
|
ОЭО |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
|
Элемент |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
ОЭО |
0,9 |
1,2 |
1,5 |
1,8 |
2,1 |
2,5 |
3,0 |
в начало
Тема 6: химическая связь и строение молекул (I часть)
1. Понятие о химической связи. Основные типы химической связи.
2. Количественная характеристика химической связи.
3. Квантово-механическое объяснение ковалентной связи.
4. Валентность и ковалентная связь с позиций метода валентных связей (МВС).
Учение о химической связи – центральный вопрос современной химии. Многообразие химических соединений, механизм их образования можно понять только, изучив природу взаимодействия атомов в веществе.
в начало
Понятие о химической связи. Основные типы химической связи.
Химическая связь – взаимодействие атомов, обусловленное перекрытием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы (молекулы, молекулярного иона, кристалла). Отсюда следует, что к основным чертам химической связи можно отнести:
а) снижение общей энергии двух и многоатомной системы по сравнению с суммарной энергией изолированных частиц, из которых эта система образована.
Б) перераспределение электронной плотности в области химической связи между атомами, сближенных на расстоянии связи.
Таким образом, условием образования химической связи является уменьшение потенциальной энергии системы взаимодействующих частиц; если же энергия образовавшейся системы не уменьшается по сравнению с суммарной энергией исходных частиц – связь не образуется. Основные положения химической связи были высказаны в период 1914-1920 гг. Основным принципом в развитии теории химической связи послужило открытие электронного строения атома.
В 1916 г. В. Коссель предположил, что при взаимодействии двух атомов один из них отдает, а другой принимает электроны, при этом образуются противоположно заряженные ионы и их взаимное электростатичес-кое притяжение приводит к образованию химической связи (теория Косселя). Дальнейшее развитие идей Косселя привело к созданию современных представлений об ионной связи.
В 1916-1918 гг. Г. Льюис предположил, что химическая связь может возникать так же путем образования электронной пары, одновременно принадлежащей двум атомам; эта гениальная догадка Г. Льюиса послужила основой для разработки современной теории ковалентной связи. Идея Льюиса об электронных парах была подтверждена и объяснена методами квантовой химии.
Современное представление о химической связи
Согласно квантово-механическим представлениям можно говорить лишь о вероятности нахождения электронов в поле атомных ядер. Данному пространственному положению атомных ядер отвечает определенное распределение электронной плотности. Выяснить как распределяется электронная плотность – описать химическую связь в веществе.
В зависимости от характера распределения электронной плотности в веществе различают три вида химической связи: ковалентную, ионную, металлическую.
в начало
Количественная характеристика химической связи.
Количественной характеристикой химической связи являются: энергия связи, длина, валентный угол, кратность связи.
Энергия связи (Есв) – количество энергии которое необходимо затратить, чтобы разорвать все имеющиеся связи между атомами в одном моле вещества. Измеряется в кДж/моль. Энергия связи определяет прочность молекулы. Чем она больше (Есв), тем прочнее молекулы. Для многоатомных соединений с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Например, энергию связи в аммиаке определяют путем деления энергии образования молекулы NH3 из атомов водорода и азота на три: энергия образования NH3 равна 1170 кДж/моль (Т = 298оК).
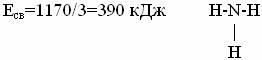
Длина
связи (![]() св)
– расстояние между ядрами атомов,
образующих соединение. Длину связи
определяют экспериментально при помощи
молекулярной спектроскопии, дифракции
рентгеновских лучей и др.
св)
– расстояние между ядрами атомов,
образующих соединение. Длину связи
определяют экспериментально при помощи
молекулярной спектроскопии, дифракции
рентгеновских лучей и др.
Имеется корреляция (зависимость) между длиной и энергией связи: с уменьшением длины связи обычно увеличивается энергия связи и соответственно устойчивость молекул. Например, в ряду галогеноводородов от HF до HJ длина связи растет, а ее энергия уменьшается.
