
- •Тема 1: химия как наука и её значение в жизни человека
- •Тема 2: периодический закон и периодическая система химических элементов д.И. Менделеева
- •Большие и малые периоды
- •Тема 3: строение атома. Ядерные превращения
- •Тема 4: строение электронной оболочки атомов
- •Тема 5: периодическое изменение свойств химических элементов
- •Оэо по Полингу
- •Тема 6: химическая связь и строение молекул (I часть)
- •Энергии (Есв) и длины (св) галогеноводородных соединений
- •Заключение по материалу «Химическая связь и строение молекул»
- •Тема 8: межмолекулярное взаимодействие
- •Тема 9: основные закономерности протекания химических процессов
- •Тема 10: направленность химических реакций
- •Тема 12: электрохимические процессы
- •Тема 13: электролиз
- •Основные понятие и особенности электролиза.
- •Отдельные примеры электролиза растворов и расплавов солей.
- •Применение электролиза
- •Закон Фарадея. Решение задач.
- •Тема 14: химия металлов и электротехнические материалы Металлическое состояние вещества
- •Тема 14: химия металлов и электротехнические материалы Физические свойства металлов
- •Тема 14: химия металлов и электротехнические материалы химические свойства металлов
- •Взаимодействие металлов с кислотами
- •Действие хлороводородной кислоты на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Тема 14: химия металлов и электротехнические материалы способы получения металлов
- •Получение металлов
- •Тема 14: химия металлов и электротехнические материалы зонная теория внутреннего строения металлов
- •I. Теория электронного газа.
- •II. Зонная теория кристаллов.
- •Выводы:
- •Тема 14: химия металлов и электротехнические материалы электротехнические материалы.
- •Сверхпроводники
Большие и малые периоды
|
Номер периода |
Число элементов |
|
Диада (n) |
|
І |
2 |
-сверхмалый |
І Число |
|
І І |
8 |
-малый |
І І элементов в |
|
І І І |
8 |
-малый |
І І периоде |
|
І V |
18 |
-большой |
І І І вычисляется по |
|
V |
18 |
-большой |
І І І формуле 2n2 |
|
V І |
32 |
-большой |
ІV (n-номер диады) |
|
V І |
неоконченный |
- |
- |
Исходя из определения периода можно сделать вывод об изменениях свойств элементов: слева направо свойства элементов изменяются отметаллических через амфотерные к неметаллическим. А следовательно свойства их соединений изменяются от основных через амфотерные к кислотным.
Например III период:

Такая закономерность имеется и в больших периодах, но металличность уменьшается значительно медленнее.
Группа – вертикальный ряд элементов, расположенных по мере увеличения заряда ядра атомов, и имеющих одинаковую электронную конфигурацию внешнего энергетического уровня, т.е. имеют одинаковое число электронов на внешних подоболочках. Отсюда элементы одной группы имеют одинаковую высшую положительную степень окисления (высшую валентность), равную номеру группы.
Таблица
|
Группы | |||||||
|
І |
І І |
І І І |
ІV |
V |
V І |
V І І |
V І І І |
|
R2O Na2O |
RO MgO |
RO2 Al2O3 |
RO2 CO2 |
R2O5 N2O5 |
RO3 SO3 |
R2O7 Cl2O7 |
RO4 OsO4 |
Исключения: у фтора степень окисления – 1( F-1); Cu, Ag, Au проявляют степень окисления +1, +2, +3; элементы VIII группы не дают соединений со степенью окисления +8 (только Os, Ru, Xe дают соединения со степенью окисления+8: OsO4, RuO4, XeO4).
Группа – понятие широкое. В одну группу входят элементы с разными химическими свойствами. По химическим свойствам элементы группы делят на подгруппы: главные (А) и побочные(В).
Главные подгруппы (А) начинаются во II периоде (элементами Li, Be, B, C, N, O, F) и благородные газы. Побочные подгруппы (В) начинаются в ІV периоде, куда также входят лантаноиды и актиноиды. Изменение химических свойств в главных (А) подгруппах следующее: сверху вниз по группе свойства элементов изменяются от неметаллических через амфотерные к металлическим, а свойства их соединений от основных через амфотерные к кислотным. Например: ІV подгруппа А:
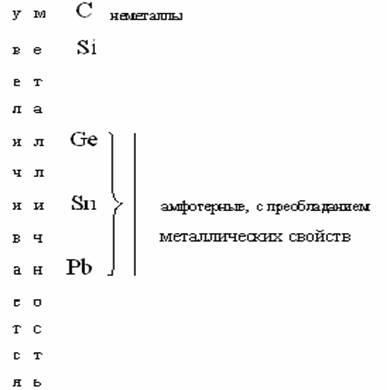
Если
в подгруппе А все
элементы металлы, то эта закономерность
остается, т.е. металличность сверху
вниз усиливается. Например, І группа
(подгруппа А): 19K более металличен,
чем 3Li,
а 55Cs металличнее 19K.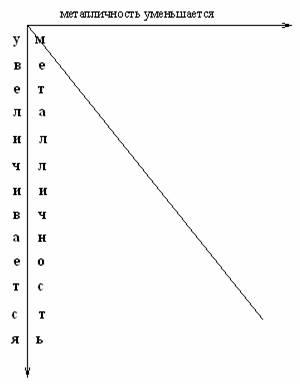
Чтобы учесть изменение химических свойств элементов по периоду и группе нужно периодическую систему разделить диагональю от H до At, и отметить изменение металличности по периоду и по группе.
Как видно из схемы, в левом нижнем углу располагаются металлы (самый металлич. Fe), а в правом верхнем – неметаллы (самый неметаллический F).
Амфотерные элементы занимают промежуточное положение между металлами и неметаллами.
Главные вопросы, которые возникли после открытия периодического закона:
1. Причины периодического изменения химических свойств элементов.
2. Причины деления групп на подгруппы.
3. Причины большого сходства лантаноидов и актиноидов.
4. Причина трёх исключений в несоответствии величины атомной массы и положения элемента в периодической системе.
На эти вопросы ученые получили ответ после изучения строения атома.
в начало
