- •Тема 1: химия как наука и её значение в жизни человека
- •Тема 2: периодический закон и периодическая система химических элементов д.И. Менделеева
- •Большие и малые периоды
- •Тема 3: строение атома. Ядерные превращения
- •Тема 4: строение электронной оболочки атомов
- •Тема 5: периодическое изменение свойств химических элементов
- •Оэо по Полингу
- •Тема 6: химическая связь и строение молекул (I часть)
- •Энергии (Есв) и длины (св) галогеноводородных соединений
- •Заключение по материалу «Химическая связь и строение молекул»
- •Тема 8: межмолекулярное взаимодействие
- •Тема 9: основные закономерности протекания химических процессов
- •Тема 10: направленность химических реакций
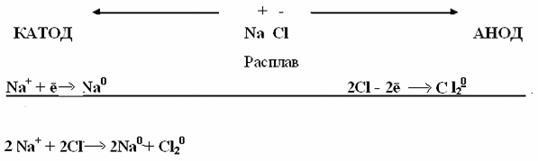
- •Тема 12: электрохимические процессы
- •Тема 13: электролиз
- •Основные понятие и особенности электролиза.
- •Отдельные примеры электролиза растворов и расплавов солей.
- •Применение электролиза
- •Закон Фарадея. Решение задач.
- •Тема 14: химия металлов и электротехнические материалы Металлическое состояние вещества
- •Тема 14: химия металлов и электротехнические материалы Физические свойства металлов
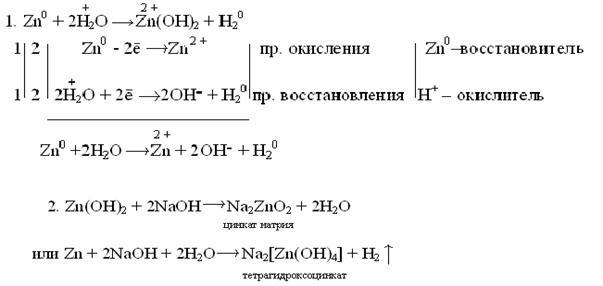
- •Тема 14: химия металлов и электротехнические материалы химические свойства металлов
- •Взаимодействие металлов с кислотами
- •Действие хлороводородной кислоты на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Тема 14: химия металлов и электротехнические материалы способы получения металлов
- •Получение металлов
- •Тема 14: химия металлов и электротехнические материалы зонная теория внутреннего строения металлов
- •I. Теория электронного газа.
- •II. Зонная теория кристаллов.
- •Выводы:
- •Тема 14: химия металлов и электротехнические материалы электротехнические материалы.
- •Сверхпроводники
Действие щелочей на металлы
Щелочи действуют только на металлы, образующие амфотерные оксиды и гидроксиды. При этом выделяется водород и образуется соль очень слабой кислоты данного металла. Следует отметить, что образование водорода является результатом взаимодействия атомов металла с ионами водорода воды, а не водорода, входящего в состав щелочи.
Таким образом, реакция идет в две стадии:
в начало
Тема 14: химия металлов и электротехнические материалы способы получения металлов
Если
при ионизации идет выделение тепла (![]() )
– такой
металл не встречается в природе в
свободном состоянии, а встречается в
виде соединений. Например:
)
– такой
металл не встречается в природе в
свободном состоянии, а встречается в
виде соединений. Например:
К0 →
К++282,15
кДж (![]() =-282,15
кДж);
=-282,15
кДж);
Mg0→ Mg2++126,25 кДж
(![]() =-126,25
кДж);
=-126,25
кДж);
Если
при ионизации идет поглощение тепла,
то для металла характерно
металлическое состояние и
он встречается в свободном виде и
называется благородным, например
Сu0→ Cu2+-33,6
кДж (![]() =33,6
кДж/моль);
=33,6
кДж/моль);
Pt ![]() =127,68 кДж/моль; Au
=127,68 кДж/моль; Au ![]() =129,78
кДж/моль.
=129,78
кДж/моль.
Степень
благородства определяется количеством
поглощённого тепла (чем больше ![]() ,
тем благороднее металл).
,
тем благороднее металл).
Получение металлов
В природе большинство металлов входят в состав руд в виде оксидов и солей (сульфидов, карбонатов, хлоридов, фосфатов, сульфатов, силикатов).
Менее активные металлы (платина, золото, медь) встречаются в самородном виде.
Получение металлов из руд – задача металлургии. Для восстановления металлов из их соединений используются различные процессы: пирометаллургические, гидрометаллургические, электрометаллургические.
Пирометаллургия основана на восстановлении металлов из безводных соединений при высоких температурах. В качестве восстановителей используют С (кокс), СО, Н2, металлы – Аl (алюминотермия), Мg (магнийтермия):
а) восстановление из оксидов металлов:
Cu2O
+ C![]() 2Cu+CO↑;
2Cu+CO↑;
3Fe2O3 +
CO![]() 2Fe3O4 +
CO2↑;
2Fe3O4 +
CO2↑;
Fe3O4 +
CO![]() 3FeO
+ CO2↑;
3FeO
+ CO2↑;
FeO +
CO![]() Fe
+ CO2↑.
Fe
+ CO2↑.
б) восстановление из сульфидов:
2ZnS +
3O2![]() 2ZnO +
2SO2 (обжиг);
2ZnO +
2SO2 (обжиг);
ZnO + C![]() Zn +
СО↑;
Zn +
СО↑;
в) восстановление металлами (металлотермия).
Когда применяется алюминий, то процесс называется алюминотермия:
Fe2O3 + 2Al → Al2O + 2Fe + Q.
В техники смесь порошков Fe2O3 и Al называют термитной.
Реакция идет с выделением тепла (экзотермичная), значит, может проходить самопроизвольно.
Термитную смесь применяют для сварки рельсов. Для этого смесь засыпают в специальный сосуд, укрепленный на стыке рельсов, зажигают ирасплавленное железа соединяет концы рельсов.
Гидрометаллургия. Металлы извлекают из руд с помощью водных растворов различных реагентов (кислот, щелочей, или солей). Затем происходит восстановление металла из раствора его соли путем электролиза. Так, если в руде есть оксид меди (II), то после обработки руды серной кислотой получают сульфат меди:
CuO + H2SO4 → CuSO4 + H2O.
Затем раствор сульфата меди подвергают электролизу и получают медь.
Электрометаллургия. Восстановление металла происходит при электролизе на катоде. Электролизом водных растворов могут быть получены лишь сравнительно малоактивные металлы. Активные же металлы, такие как щелочные, щелочноземельные, алюминий, получают исключительно электролизом расплавов их солей по схеме: