
- •Тема 1: химия как наука и её значение в жизни человека
- •Тема 2: периодический закон и периодическая система химических элементов д.И. Менделеева
- •Большие и малые периоды
- •Тема 3: строение атома. Ядерные превращения
- •Тема 4: строение электронной оболочки атомов
- •Тема 5: периодическое изменение свойств химических элементов
- •Оэо по Полингу
- •Тема 6: химическая связь и строение молекул (I часть)
- •Энергии (Есв) и длины (св) галогеноводородных соединений
- •Заключение по материалу «Химическая связь и строение молекул»
- •Тема 8: межмолекулярное взаимодействие
- •Тема 9: основные закономерности протекания химических процессов
- •Тема 10: направленность химических реакций
- •Тема 12: электрохимические процессы
- •Тема 13: электролиз
- •Основные понятие и особенности электролиза.
- •Отдельные примеры электролиза растворов и расплавов солей.
- •Применение электролиза
- •Закон Фарадея. Решение задач.
- •Тема 14: химия металлов и электротехнические материалы Металлическое состояние вещества
- •Тема 14: химия металлов и электротехнические материалы Физические свойства металлов
- •Тема 14: химия металлов и электротехнические материалы химические свойства металлов
- •Взаимодействие металлов с кислотами
- •Действие хлороводородной кислоты на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Тема 14: химия металлов и электротехнические материалы способы получения металлов
- •Получение металлов
- •Тема 14: химия металлов и электротехнические материалы зонная теория внутреннего строения металлов
- •I. Теория электронного газа.
- •II. Зонная теория кристаллов.
- •Выводы:
- •Тема 14: химия металлов и электротехнические материалы электротехнические материалы.
- •Сверхпроводники
Отдельные примеры электролиза растворов и расплавов солей.
Рассмотрим несколько случаев электролиза водных растворов:
1. Электролиз растворов CuCl2 с инертным анодом.
Медь в ряду стандартных потенциалов расположена после водорода (φ Cu+/Cu2+ = 0,34B), поэтому у катода будет разряжаться ионы Cu2+ и выделяется свободная медь.
У анода будет разряжаться хлорид-иона.
Схема электролиза:
Катод(-) Cu2+ + 2ē → Cu °
Анод(+) 2Cl- - 2ē → Cl2
|
| |
|
|
|
Cu2+ + 2Cl- → Cu + Cl2
Установлено, что электролиз проходит только при некоторой определенной величине электрического напряжения. Минимальное напряжение, необходимое для разложения электролита, называемое потенциалом разложения, вычисляется теоретическим путем вычитания из электродного потенциала анода электродного потенциала катода (Е разл(теор.)). В данном случае (φ Cu+/Cu2+ = 0,34B, φ Cl2/2Cl- = 1,36B),
Е разл. = 1,36-0,34 = 1,02В.
2. Электролиз раствора К2SO4 c инертным анодом.
Поскольку калий имеет очень малую величину электродного потенциала (φ К/К+ =-2,9В), то у катода будет происходить выделение водорода и накопление ОН-. У анода будет идти выделение кислорода и накопление Н+ .
В целом раствор во всех частях будет электронейтральным, однако в катодном пространстве будет накапливаться щелочь, а в анодном – кислота.
Схема электролиза:
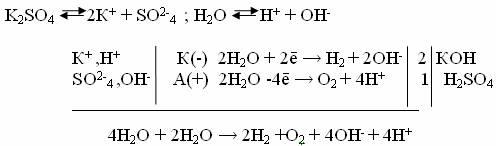
Как видно из записи схемы электролиза раствора K2SO4 , происходит электролиз воды, а количество растворенной соли останется неизменным, ее роль сведется лишь к созданию электропроводящий среды.
3. Электролиз раствора NiSO4 c растворимым анодом из никеля.
Стандартный потенциал никеля (φ Ni/Ni2+ = -0,25B) несколько больше, чем у водорода в нейтральной среде (рН=7), где он равен -0,41В. Расчет потенциала водорода в нейтральной среде проводят по уравнению:
φ = -0,059 ∙ 7=-0,41В
Поэтому при электролизе нейтрального раствора NiSO4 на катоде в основном происходит разряд ионов Ni2+ и выделение металла. На аноде происходит противоположенный процесс- окисление металла, т.к. потенциал никеля намного меньше потенциала окисления воды, а тем более потенциала окисления иона SO42-(φ Ni/Ni2+ = -0,25B; φ SO42-/ S2O82- = 2,01B, φН2О/О2 = 1,22В). Таким образом, в данном случае электролиз сводится к растворению металла анода и выделению его на катоде (перенос материала анода на катод).
Схема электролиза:
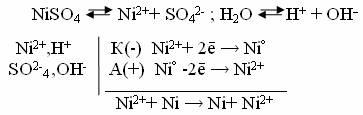
Этот процесс применяется для очистки никеля (так называемое электролитическое рафинирование).
4. Электролиз раствора NaCl с инертным анодам.
Натрий имеет очень малую величину электродного потенциала (φ Nа/Nа+ = -2,7B). У катода будет происходить восстановление водорода и накопление ионов ОН- . У анода происходит окисление Cl- до свободного состояния.
Схема электролиза:
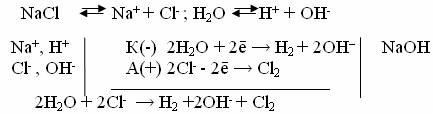
5. Электролиз расплава NaCl с инертным анодом.
При плавлении хлорида натрия происходит термохимическая диссоциация соли: Na+Cl- . На катоде идет восстановление ионов Na+ до металлического натрия, на аноде – окисления ионов Cl- до свободного состояния.
Схема электролиза:
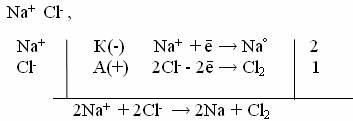
Сравнивая электролиз раствора и расплава NaCl, можно сделать вывод: очень активные металлы (Li, Na, K, Ba, Mg, Sr, Ca) можно получить только электролизом расплавов их солей.
Как показали исследования, довольно часто электролиз (разряд ионов) начинается при напряжении, значительно превышающем теоретическивычисленное.
Например, согласно теоретическому подсчету, электролиз 1м раствора NaOH должен проходить при напряжении 1,22В. Практически же он проходит при 1,67В. Разность между потенциалом разложения, фактически необходимого для протекания электролиза, и теоретического найденного, носит название перенапряжения. Рассчитаем для нашего примера:
Е перен =Е разл (опр) – Е разл (теор) = 1,67 – 1,22 = 0,45В.
Перенапряжение вызывает непроизводительный добавочный расход энергии, поэтому на практике стараются создать такие условия, при каторыхвеличина перенапряжения становится минимальной (применяет по возможности невысокие плотности тока).
в начало
