
- •Міністерство освіти і науки україни
- •Кірсенко Тетяна Володимирівна, канд. Хім. Наук, доц.
- •Визначення молярної маси леткої рідини
- •Виконання роботи
- •Калориметрія
- •Виконання роботи
- •Хімічна рівновага
- •Виконання роботи
- •Тиск насиченої пари рідини
- •Виконання роботи
- •Необмежено розчинні рідини
- •Виконання роботи
- •Обмежено розчинні рідини
- •Виконання роботи
- •7. Коефіцієнт розподілу
- •Виконання роботи
- •Кріоскопія
- •Виконання роботи
- •Термічний аналіз
- •Виконання роботи
- •Список рекомендованої літератури
Визначення молярної маси леткої рідини
При
невисоких температурах та наближених
до стандартного тисках для реальних
газів та парів можна використовувати
рівняння стану ідеального газу (рівняння
Менделєєва - Клапейрона), яке для
![]() молів газу має вигляд:
молів газу має вигляд:
![]() , (1.1)
, (1.1)
де
![]() − відповідно тиск, об’єм та температура
газу, а
− відповідно тиск, об’єм та температура
газу, а![]() – універсальна газова стала. Враховуючи
те, що
– універсальна газова стала. Враховуючи
те, що![]() ,
де
,
де![]() - маса пари, а
- маса пари, а![]() –
молярна маса речовини, рівняння (1.1)
можна записати як:
–
молярна маса речовини, рівняння (1.1)
можна записати як:
![]() . (1.2)
. (1.2)
Маса
речовини не залежить від її агрегатного
стану, тому за рівнянням (1.2)
можна експериментально визначити
молярну масу леткої рідини, якщо її
відому масу
![]() перевести в пару та виміряти тиск, об’єм
та температуру утвореної пари. Формула
для розрахунку молярної маси матиме
вигляд:
перевести в пару та виміряти тиск, об’єм
та температуру утвореної пари. Формула
для розрахунку молярної маси матиме
вигляд:
![]() . (1.3)
. (1.3)
Виконання роботи
Мета роботи: визначити молярну масу леткої рідини за рівнянням Менделєєва – Клапейрона.
Колбу 1 для випаровування рідини (рис. 1) з’єднують короткою гумовою трубкою з газовідвідною трубкою 2, занурюють у водяну баню 3, закріплюють у штативі і щільно закривають пробкою. В евдіометр 4 (калібровану скляну трубку) наливають до краю воду, закривають його скляною пластиною або долонею, перевертають, опускають закритий кінець у ванну з водою 5 і закріплюють вертикально у штативі.

Запалюють газовий пальник. Повітря в колбі починає нагріватись, розширюватись і виходити бульбашками з газовідвідної трубки, яка занурена у ванну 5. Після того, коли вода у водяній бані закипить і бульбашки повітря припинять виділятися, температура приладу не змінюватиметься.
Газовідвідну
трубку підводять під евдіометр.
Відкривають пробку колби 1, швидко
вкидають в неї злегка прикриту корком
ампулу 6 з досліджуваною рідиною, маса
якої відома, і знову щільно закривають
колбу пробкою. На дні колби повинна бути
скловата, щоб ампула при падінні не
розбила колбу. У колбі рідина випаровується,
її пара витісняє повітря в евдіометр,
за допомогою якого визначається об’єм
газу
![]() .
Об’єм витісненого повітря відповідає
об’єму, який би займала пара досліджуваної
рідини, маючи такі самі температуру та
тиск, за яких перебуває повітря в
евдіометрі. Коли витіснення повітря
припиняється, експеримент закінчується.
Після цього обов’язково потрібно
погасити газовий пальник та відкрити
пробку колби 1, інакше внаслідок
охолодження в колбі створиться розрідження
і в неї потрапить вода з ванни 5.
.
Об’єм витісненого повітря відповідає
об’єму, який би займала пара досліджуваної
рідини, маючи такі самі температуру та
тиск, за яких перебуває повітря в
евдіометрі. Коли витіснення повітря
припиняється, експеримент закінчується.
Після цього обов’язково потрібно
погасити газовий пальник та відкрити
пробку колби 1, інакше внаслідок
охолодження в колбі створиться розрідження
і в неї потрапить вода з ванни 5.
Після
закінчення експерименту визначають
температуру і тиск в лабораторії.
Вимірюють також об’єм повітря в
евдіометрі
![]() та різницю рівнів води
та різницю рівнів води![]() в евдіометрі і ванні 5 (рис. 1).
в евдіометрі і ванні 5 (рис. 1).
Молярну масу рідини обчислюють за рівнянням (1.3), враховуючи те, що:
![]() (мм
рт.ст.см3)/(мольК);
(мм
рт.ст.см3)/(мольК);
![]() –температура
повітря в евдіометрі, яку приймають
рівною температурі в лабораторії, К;
–температура
повітря в евдіометрі, яку приймають
рівною температурі в лабораторії, К;
![]() –тиск
повітря в евдіометрі, який визначають
за рівнянням:
–тиск
повітря в евдіометрі, який визначають
за рівнянням:
![]() , (1.4)
, (1.4)
де
![]() – барометричний (атмосферний) тиск, мм
рт. ст.;
– барометричний (атмосферний) тиск, мм
рт. ст.;![]() –
різниця рівнів води в евдіометрі та у
ванні 5, мм; 13,6 – відношення густини Hg
до густини Н2О;
–
різниця рівнів води в евдіометрі та у
ванні 5, мм; 13,6 – відношення густини Hg
до густини Н2О;
![]() –
тиск насиченої водяної пари при
температурі досліду, який визначається
за табл.1.1.,
мм рт. ст.;
–
тиск насиченої водяної пари при
температурі досліду, який визначається
за табл.1.1.,
мм рт. ст.;
![]() –об’єм
повітря в евдіометрі, см3.
–об’єм
повітря в евдіометрі, см3.
Таблиця 1.1 – Тиск насиченої водяної пари при різних температурах
|
t, 0С |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
В, мм рт. ст. |
15,5 |
16,5 |
17,5 |
18,7 |
19,8 |
21,1 |
22,4 |
23,7 |
Звіт
Досліджувана рідина:
 г/моль.
г/моль.Дані експерименту:
маса
рідини ![]() г;
г;
температура
повітря в евдіометрі ![]() К;
К;
атмосферний
тиск ![]() мм
рт. ст.;
мм
рт. ст.;
об’єм
повітря в евдіометрі ![]() см3;
см3;
різниця
рівнів води ![]() мм;
мм;
тиск
насиченої водяної пари ![]() мм
рт. ст.
мм
рт. ст.
Розрахунок тиску повітря в евдіометрі за (1.4):
 мм
рт. ст.
мм
рт. ст.Розрахунок експериментального значення молярної маси леткої рідини (результат скорочується до цілого числа):
 г/моль.
г/моль.Визначення відносної похибки експерименту:
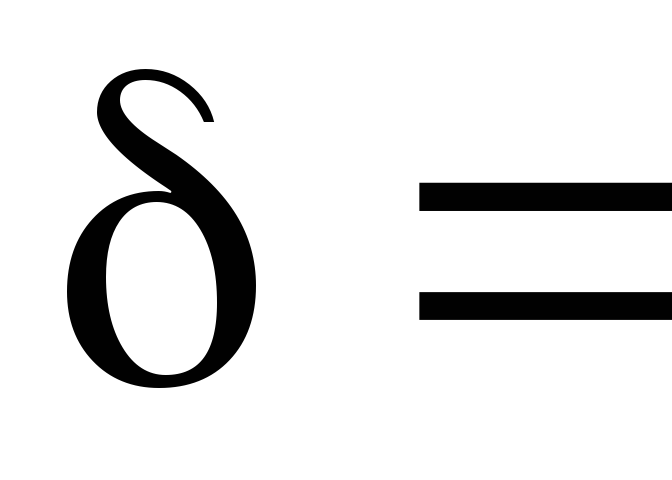 %.
%.Висновок.
ЛІТЕРАТУРА: [1, с. 184; 2, с. 64; 3, с.13; 7, с. 13 – 15].
