
- •3.Неконпенсированная теплота
- •12 Скорость хим реакции методы измерения
- •13.Закон формальной кинетики
- •14 Порядок рекций
- •15.Методы определения порядка,время полупревращения
- •21.Методы определения степени диссоциации
- •Методы определения
- •25. Поверхностная энергия Гиббса,Поверхностное натяжение
- •26.Уравнение изотрмы,абсорции Гибсса
- •Изотерма химической реакции (изотерма Вант-Гоффа)
- •27.Адсорбция на твердых абсольвентах
- •28. Теория адсорбции.Газовая храмотография
26.Уравнение изотрмы,абсорции Гибсса

Три частных случая термического уравнения (когда Т, р или a - константы) играют особую роль в теории адсорбции:
а=![]() -
уравнение изотермы адсорбции,
-
уравнение изотермы адсорбции,
Т=![]() -
уравнение изобары адсорбции,
-
уравнение изобары адсорбции,
Р-![]() -
уравнение изостеры адсорбции.
-
уравнение изостеры адсорбции.
Изотерма химической реакции (изотерма Вант-Гоффа)
При самопроизвольном протекании химической реакции изменение свободной энергии системы отлично от нуля (ΔG < 0, ΔF < 0). Т.о., для самопроизвольного процесса можно записать:
 (39)
(39)
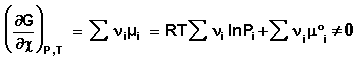 (40)
(40)
При протекании реакции в большом количестве реакционной смеси, таком, что при превращении ni молей каждого из компонентов концентрации реагентов Сi практически не изменяются, частную производную свободной энергии Гельмгольца по химической переменной можно заменить равной ей величиной отношения ΔF к Δχ, т.е. принять, что
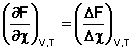
Положив Δχ = 1, получаем
![]() (41)
(41)
Поскольку,
как следует из (35,37), ![]() ,
окончательно получаем уравнение,
называемое изотермой
химической реакции (изотермой
Вант-Гоффа):
,
окончательно получаем уравнение,
называемое изотермой
химической реакции (изотермой
Вант-Гоффа):
![]() (42)
(42)
![]() (43)
(43)
Энергия Гиббса процесса адсорбции рассчитывается по уравнению
![]() ,
(1.5.18)
,
(1.5.18)
где Kа– постоянная адсорбционного равновесия, учитывающая обменный характер адсорбции из растворов. Эта постоянная определяется по начальному участку изотермыадсорбции при формировании ненасыщенного адсорбционного слоя.
Адсорбционный молекулярный слой, формируемый при адсорбции из растворов, можно рассматривать как двумерную фазу, в которой отношение компонентов определяется различиями в энергии взаимодействия их молекул с активными центрами поверхности адсорбента, а суммарное относительное заполнение поверхности всегда равно единице, т.е. для двухкомпонентного раствора в расчете на единицу массы адсорбента
 ,
(1.5.19)
,
(1.5.19)
где ![]() –
площадь, занятая молекулой растворителя и
растворенного вещества в
адсорбционном слое;
–
площадь, занятая молекулой растворителя и
растворенного вещества в
адсорбционном слое; ![]() –
число молей адсорбированных растворителя и
растворенноговещества; Aуд– удельная
поверхность адсорбента;
–
число молей адсорбированных растворителя и
растворенноговещества; Aуд– удельная
поверхность адсорбента; ![]() -число
Авогадро;
-число
Авогадро; ![]() -
доля поверхности, занятая молекулами растворителя и
ПАВ, соответственно.
-
доля поверхности, занятая молекулами растворителя и
ПАВ, соответственно.
27.Адсорбция на твердых абсольвентах
Характерной особенностью твердых поверхностей является их пористость (отношение суммарного объема пор к общему объему адсорбента). Природа поверхности адсорбента, размеры и форма его пор влияют на адсорбцию, изменяют ее характеристики, т.е. механизм адсорбции.
Особенности адсорбции на поверхности твердых тел. Твердые поверхности в качестве адсорбентов используются для адсорбции газов или жидкостей, а адсорбционные процессы при этом протекают на границе раздела твердое тело - газ и твердое тело — жидкость. Твердые адсорбенты имеют поры различного размера.
Адсорбция на микропористых адсорбентах заключается объемном заполнении пространства пор, а адсорбция на мезопористых адсорбентах - в капиллярной конденсации паров адсорбата. Адсорбционная емкость микропор определяется не только их удельной поверхностью, но и объемом самих микропор.
Адсорбция газов. Адсорбция газов на микро- и мезопористых адсорбентах существенным образом отличается от их адсорбции на непористых и макропористых адсорбентах. Для непористых и макропористых адсорбентов наблюдается мономолекулярная и полимолекулярная адсорбция. В случае порошкообразных адсорбентов различие между ними обусловлено лишь величиной удельной поверхности.
Адсорбция жидкости. Адсорбция на поверхности твердого тела, граничащего с жидкостью, в зависимости от природы адсорбтива и адсорбента и механизма процесса может быть молекулярной, ионной и ионообменной. Молекулярная адсорбция осуществляется из растворов, а адсорбтивом являются молекулы растворенного вещества. К разновидностям молекулярной адсорбции относится адсорбция ПАВ.
Адсорбция ионов. Адсорбция ионов на твердой поверхности протекает в том случае, когда эта поверхность соприкасается с растворами электролитов. Ионы одного знака удерживаются на твердой поверхности сильнее, чем ионы другого знака, которые остаются в растворе. Удержание ионов твердым телом определяется электростатическими и химическими силами, которые зависят от свойств твердого тела и самих ионов.
Ионообменная адсорбция. Ионный обмен связан с адсорбцией ионов из раствора электролита и десорбции ионов из твердой поверхности (ионита) в раствор. Поэтому ионный обмен называют ионообменной адсорбцией. Иониты представляют собой вещества, способные к ионному обмену при контакте с растворами электролитов. Ионит имеет две группы ионов, одна из них содержится в фазе ионита, а другая способна диссоциировать и является электролитом. По знаку обмениваемых ионов различают катиониты и аниониты.
