
- •3.Неконпенсированная теплота
- •12 Скорость хим реакции методы измерения
- •13.Закон формальной кинетики
- •14 Порядок рекций
- •15.Методы определения порядка,время полупревращения
- •21.Методы определения степени диссоциации
- •Методы определения
- •25. Поверхностная энергия Гиббса,Поверхностное натяжение
- •26.Уравнение изотрмы,абсорции Гибсса
- •Изотерма химической реакции (изотерма Вант-Гоффа)
- •27.Адсорбция на твердых абсольвентах
- •28. Теория адсорбции.Газовая храмотография
15.Методы определения порядка,время полупревращения
Каким путем можно установить порядок реакции? Наиболее общим методом для этого является установление зависимости концентрации от времени при постоянной температуре. Рассмотрим кинетические уравнения для реакций нулевого, первого и второго порядка.
В реакциях нулевого порядка скорость не зависит от концентраций, т.е. постоянна:
ω = -dc/dτ = k. (XVI.2)
Зависимость концентрации от времени может быть найдена интегрированием этого уравнения: c = -kτ + B, где B - постоянная, равная концентрации в начальный момент времени. Для реакции первого порядка
ω = -dc/dτ = kc. (XVI.3)
Чтобы найти зависимость концентрации от времени, следует проинтегрировать это уравнение, разделив переменные и взяв в качестве пределов c = c0 при τ = 0 и при τ = τ - c:

Отсюда
ln(c0/c) = kτ (XVI.4)
или
421
k = 1/τln(c0/c). (XVI.5)
При потенцировании уравнения (XVI.5) получаем
c = c0e-kτ. (XVI.6)
Из уравнения (XVI.5) следует, что константа скорости реакции первого порядка имеет размерность τ-1 и, следовательно, ее численное значение не зависит от единиц, в которых выражается концентрация.
Из уравнения (XVI.6), видно, что концентрация исходного вещества экспоненциально уменьшается со временем τ, прошедшим с начала реакции. Из уравнения (XVI.4) следует, что логарифм концентрации линейно уменьшается со временем (так как lnc = lnc0 - kτ). Это показано на рис. XVI.2, а и б, где прямая и кривая линии построены в разных координатах. Если опытные данные укладываются на прямую линию в координатах ln сτ в широком интервале концентраций, то это может служить доказательством того, что рассматриваемая реакция имеет первый порядок.
Часто уравнение (XVI.4) используют в несколько другой форме: вводят концентрацию х образовавшегося к моменту τ продукта реакции, а начальную концентрацию c0 обозначают через а. В этом случае ln (a/a - x) = kτ.
Для характеристики реакций часто наряду с величиной константы скорости пользуются величиной времени полупревращения τ 1/2 т.е. времени, в течение которого претерпевает превращение половина исходного вещества c = c0/2. Очевидно, для реакций первого порядка, согласно уравнению (XVI.4), τ1/2 = (1/k)ln2 не зависит от исходной концентрации.
Для реакций второго порядка, если реагенты имеют одинаковые концентрации, кинетическое уравнение имеет вид
-dc/dτ = kc2. (XVI.7)
После разделения переменных и интегрирования получим
 и
(1/с)
- (1/с0)
= kτ (XVI.8)
и
(1/с)
- (1/с0)
= kτ (XVI.8)
Отсюда следует, что для реакции второго порядка должна соблюдаться прямолинейная зависимость между величинами 1/с и τ.
Время полупревращения при реакциях второго порядка зависит от начальной концентрации, т.е. τ1/2 = 1/kc0
422
Пусть в реакции второго порядка принимают участие два вещества, начальные концентрации которых равны а и b, и оба вещества входят в реакцию с одинаковыми стехиометрическими коэффициентами. Если к моменту времени τ в единице объема прореагируют количества этих веществ, равные х, то скорость реакции выразится уравнением
dx/dτ = k(a - x)(b - x). (XVI.9)
После интегрирования уравнения (XVI.9) в пределах от x = 0 при τ = 0 до х при τ = τ
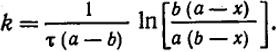 (XVI.10)
(XVI.10)
При а = b уравнение (XVI.9) упрощается, т.е.
dx/dτ = k(a - x)2. (XVI.11)
Константа скорости реакции второго порядка имеет размерность [τ-1M-1L3] и ее численное значение зависит от единиц, в которых выражается концентрация.
Для реакции n-го порядка время полупревращения выражается формулой
τ1/2 ≈ 1/an - 1 (XVI.12)
Подобные соотношения иногда используют для определения порядка реакции.
18 Общие понятия гетерогенных реакций
Гетерогенной называется система, состоящая из нескольких фаз
(вода + лед; насыщенный раствор + осадок)

19.Процесс стационарно диффузии


20 Диффузия вещества с наличием градиента корреляции


21.Электронные процессы,терема Арениусса


Уравне́ние
Арре́ниуса устанавливает
зависимость константы скорости химической
реакции ![]() от температуры
от температуры ![]() .
.
Согласно
простой модели столкновений химическая
реакция между двумя исходными веществами
может происходить только в результате
столкновения молекул этих
веществ. Но не каждое столкновение ведёт
к химической реакции. Необходимо
преодолеть определённый энергетический
барьер, чтобы молекулы начали друг с
другом реагировать. То есть молекулы
должны обладать некой минимальной
энергией (энергия
активации ![]() ),
чтобы этот барьер преодолеть.
Из распределения
Больцмана для
кинетической энергии молекул известно,
что число молекул, обладающих энергией
),
чтобы этот барьер преодолеть.
Из распределения
Больцмана для
кинетической энергии молекул известно,
что число молекул, обладающих энергией ![]() ,
пропорционально
,
пропорционально ![]() .
В результате скорость химической реакции
представляется уравнением, которое
было получено шведским химиком Сванте
Аррениусом из
термодинамических соображений:
.
В результате скорость химической реакции
представляется уравнением, которое
было получено шведским химиком Сванте
Аррениусом из
термодинамических соображений:
![]()
Здесь ![]() характеризует
частоту столкновений реагирующих
молекул,
характеризует
частоту столкновений реагирующих
молекул, ![]() — универсальная
газовая постоянная.
— универсальная
газовая постоянная.
В
рамках теории активных соударений ![]() зависит
от температуры, но эта зависимость
достаточно медленная:
зависит
от температуры, но эта зависимость
достаточно медленная:
![]()
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений A на 10 %.
В
рамках теории активированного комплекса
получаются другие зависимости ![]() от
температуры, но во всех случаях более
слабые, чем экспонента.
от
температуры, но во всех случаях более
слабые, чем экспонента.
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
