- •И. В. Крепышева химия
- •Химия. Ученое пособие для студентов, обучающимся по техническим направлениям и специальностям. И.В. Крепышева. – Березники: Перм. Гос. Техн. Ун-т., 2010. – 183 с.
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Внутренняя энергия
- •1.3. Энтальпия
- •1.4. Термохимия. Закон Гесса
- •1.5. Энтропия
- •1.6. Самопроизвольные процессы. Энергия Гиббса
- •1.7. Решение типовых задач
- •1.8. Задачи для самостоятельного решения
- •Тема 2. Химическая кинетика и химическое равновесие
- •2.1. Скорость химической реакции
- •2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •2.3. Зависимость скорости реакции от температуры
- •2.4. Катализ
- •2.5. Химическое равновесие
- •2.6. Смещение химического равновесия. Принцип Ле Шателье
- •2.7. Решение типовых задач
- •2.8. Задачи для самостоятельного решения
- •Тема 3. Строение атома и периодическая система элементов д.И. Менделеева
- •3.1. Первые модели строения атома
- •3.2. Квантово-механическая модель атома водорода
- •3.3. Строение многоэлектронных атомов
- •3.4. Периодическая система элементов д. И. Менделеева
- •3.5. Периодические свойства элементов
- •3.6. Решение типовых задач
- •3.7. Задачи для самостоятельного решения
- •Тема 4. Химическая связь
- •4.1. Ковалентная связь
- •4.2. Гибридизация атомных орбиталей
- •4.3. Ионная химическая связь
- •4.4. Металлическая связь
- •4.5. Водородная связь
- •4.6. Строение твердого тела
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л- объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •1. Важнейшие единицы си и их соотношение с единицами других систем
- •2. Приставки для дольных и кратных единиц си
- •3. Термодинамические характеристики некоторых веществ при 298 к
- •5. Энергия разрыва связи
- •6. Электроотрицательность элементов по Полингу
- •7. Стандартные окислительно-восстановительные потенциалы элементов
- •8. Таблица растворимости соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •9. Константы диссоциации Кд слабых электролитов
- •10. Распределение электронов в атоме
- •Список литературы
8.3. Электрохимическая коррозия
Механизм электрохимической коррозии. Коррозия металлов в средах, имеющих ионную проводимость, протекает через анодное окисление металла:
![]()
и катодное восстановление окислителя.
![]() ,
где
,
где
![]() - окислитель
- окислитель
![]() - восстановленная
форма
- восстановленная
форма
Окислителями при
коррозии служат молекулы
![]() ,
ионы
,
ионы![]() и др. Наиболее часто при коррозии
наблюдается ионизация (восстановление)
кислорода:
и др. Наиболее часто при коррозии
наблюдается ионизация (восстановление)
кислорода:
в нейтральной или щелочной среде:
![]()
в кислой среде
![]()
и выделение водорода
![]()
|
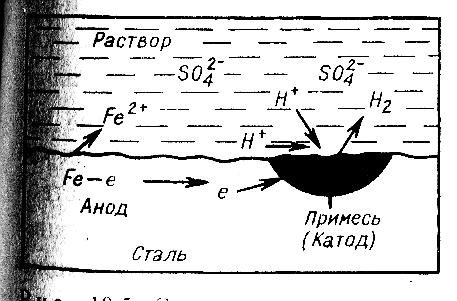
Рис. 7.1. Схема коррозии стали при контакте с водой с поглощением кислорода (атмосферная коррозия) |
Коррозия с участием кислорода называется коррозией с поглощением кислорода (коррозия с кислородной деполяризацией) (рис.8.1). Коррозия с участием ионов водорода называется коррозией с выделением водорода (коррозия с водородной деполяризацией) (рис.8.2).
|
|
Рис.8.2. Схема коррозии стали в растворе H2SO4с выделением водорода |
Кроме анодных и катодных реакций при электрохимической коррозии происходит движение электронов в металле и ионов в электролите. Электролитами могут быть растворы солей, кислот и оснований, морская вода, почвенная вода, вода атмосферы, содержащая CO2, SO2, O2. |
Кроме электрохимических реакций при коррозии обычно протекают вторичные химические реакции, например взаимодействие ионов металла с гидроксид-ионами, концентрация которых повышается в результате катодных реакций
Mn+ + nOH- = M(OH)n
Как видно, процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах.
Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри него.
Схема электрохимической коррозии железа в контакте с углеродом приведена на рис 8.2. На анодных участках происходит реакция окисления железа
Fe – 2e → Fe2+
На катодных участках происходит восстановление водорода
2Н+ + 2е → Н2
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микро - а макрогальванопара, и коррозия называется контактной. Сочетания металлов, сильно отличающихся значениями электродных потенциалов, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
Коррозия металла в результате неравномерного доступа кислорода. Случаи электрохимической коррозии, возникающей вследствие неравномерной аэрации кислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис 8.3.).

Рис. 8.3. – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет катодом. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
Кислородный электрод. Аналогично водородному электроду можно создать кислородный электрод. Для этого платиновую пластину приводят в контакт с О2 и раствором, содержащими ионы, которые образуются при восстановлении О2 (ионы ОН-):
![]()
на кислородном электроде протекает реакция:
![]()
![]() В
В
потенциал кислородного электрода при 298К описывается уравнением
![]()
потенциал водородного электрода описывается уравнением
![]()