
- •Лекция n 20-23. Растворы электролитов
- •1. Растворы электролитов. Слабые электролиты. Закон разбавления Оствальда
- •Растворы слабых электролитов
- •2. Сильные электролиты. Активность. Ионная сила раствора
- •3. Электролитическая диссоциация воды, рН раствора. Расчет рН растворов сильных и слабых электролитов..
- •Расчет рН растворов сильных и слабых электролитов.
- •4. Буферные растворы. Буферные системы живых организмов.
- •Типы буферных систем.
- •Расчет рН буферных растворов.
- •Механизм действия буферных систем
- •Буферные системы живого организма
- •3.Белковые буферные системы.
- •5. Гидролиз солей
- •Влияние различных факторов на гидролиз.
- •6. Равновесие в системе осадок – раствор электролита
- •Условия растворения и осаждения труднорастворимых электролитов
- •7. Равновесия в растворах комплексных соединений
- •Токсичность солей тяжелых металлов
Лекция n 20-23. Растворы электролитов
План
Растворы электролитов. Слабые электролиты. Закон разбавления Оствальда.
Сильные электролиты. Активность. Ионная сила раствора.
Электролитическая диссоциация воды, рН раствора. Расчет рН растворов сильных и слабых электролитов.
Буферные растворы. Буферные системы живых организмов.
Гидролиз солей.
Равновесие в системе осадок – раствор электролита.
Равновесия в растворах комплексных соединений.
1. Растворы электролитов. Слабые электролиты. Закон разбавления Оствальда
Электролиты – это вещества, растворы которых проводят электрический ток посредством ионов, на которые они распадаются под действием полярных молекул растворителя.
По типу диссоциации электролиты разделяют на кислоты, основания, амфотерные гидроксиды и соли.
Количественной характеристикой диссоциации электролита является степень диссоциации , которая равна отношению числа продиссоциировавших молекул к общему числу молекул:
П![]() о
степени диссоциации различают сильные
электролиты (>30%),
слабые электролиты (<3%)
и электролиты средней силы (3% <<30%).
о
степени диссоциации различают сильные
электролиты (>30%),
слабые электролиты (<3%)
и электролиты средней силы (3% <<30%).
Степень диссоциации не является строгой характеристикой электролита, так как зависит не только от его природы, но и от концентрации, и увеличивается при разбавлении раствора.
Растворы слабых электролитов
Диссоциация слабых электролитов – обратимый процесс, к которому применим закон действия масс:
![]()
Константу равновесия процесса диссоциации называют константой диссоциации.
![]()
Если диссоциация протекает по ступеням, то каждая ступень диссоциации характеризуется своей константой:
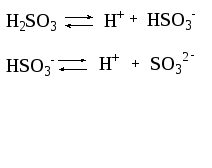
1-ая ступень:
2-ая ступень:
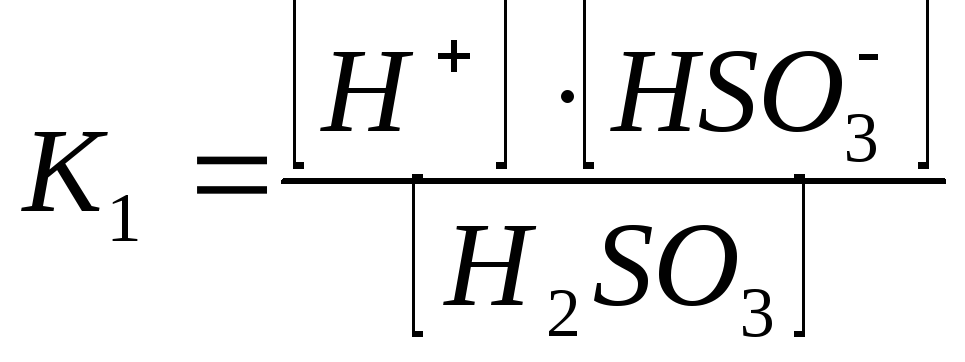
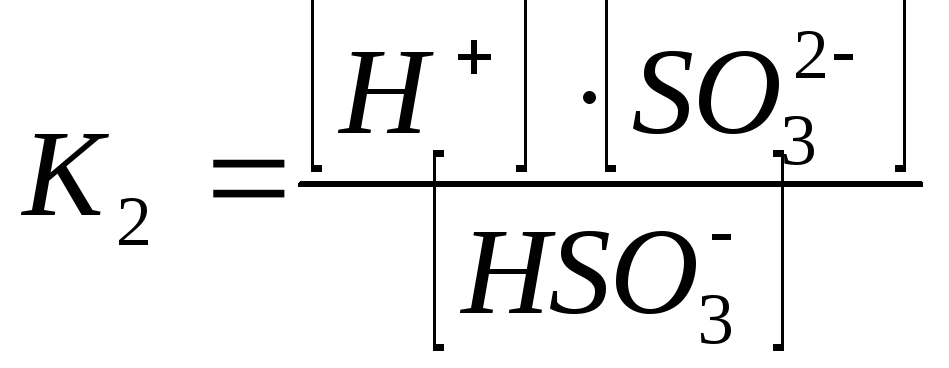
При этом К1>К2 , а Ксум=К1К2.
Константа диссоциации, как и любая константа равновесия, не зависит от концентрации и является строгой характеристикой электролита при данной температуре. Для слабых электролитов Кдисс< 10-4.
Зависимость константы диссоциации от температуры определяется знаком теплового эффекта процесса диссоциации.
Рассмотрим процесс диссоциации слабого электролита HA с концентрацией c и степенью диссоциации :
![]()
![]()
Cогласно уравнению диссоциации:
[H+] = [A-] =c.
Тогда
[HA] = (1-) c.
После подстановки полученных выражений в уравнение для константы диссоциации получим:
![]()
Так как <<1, то ее величиной в знаменателе можно пренебречь:
К=2с
или
![]()
Полученное соотношение является математическим выражением закона разбавления Оствальда:
Степень диссоциации электролита возрастает при разбавлении раствора.
2. Сильные электролиты. Активность. Ионная сила раствора
Установлено, что сильные электролиты в растворе полностью распадаются на ионы, т.е. истинное значение =1. Однако величина степени диссоциации, определяемая по физическим свойствам этих растворов (электропроводность, температура замерзания и т.д.), всегда меньше единицы. Кроме того, к растворам сильных электролитов неприменим закон действия масс в его обычной форме.
Наблюдаемые отклонения в свойствах растворов сильных электролитов связаны с сильным электростатическим взаимодействием ионов в растворе. Каждый ион окружен “ионной атмосферой “ из ионов противоположного знака, которая влияет на его подвижность и вызывает отклонение свойств от ожидаемых величин.
Для характеристики растворов сильных электролитов вместо их истинной концентрации используют активность (a), т.е. условную эффективную концентрацию, в соответствии с которой они проявляют себя в химических и физических процессах:
a = c ,
где - коэффициент активности;
с – истинная концентрация.
Коэффициент активности определяется экспериментально и приводится в таблицах. Для разбавленных растворов электролитов не зависит от природы иона и может быть рассчитан по формуле:
lg
= - 0,5z2![]() ,
,
где I – ионная сила раствора, которая определяется по формуле:
I = 0,5 (b(X1)z12+ b(X2)z22+ …+b(Xn)zn2)
b(X) - моляльные концентрации ионов
z – заряды ионов.
Для предельно разбавленных растворов, в которых практически отсутствует взаимодействие между ионами, а=с , т.е. =1.
