
- •И. В. Крепышева химия
- •Химия. Ученое пособие для студентов, обучающимся по техническим направлениям и специальностям. И.В. Крепышева. – Березники: Перм. Гос. Техн. Ун-т., 2010. – 183 с.
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Внутренняя энергия
- •1.3. Энтальпия
- •1.4. Термохимия. Закон Гесса
- •1.5. Энтропия
- •1.6. Самопроизвольные процессы. Энергия Гиббса
- •1.7. Решение типовых задач
- •1.8. Задачи для самостоятельного решения
- •Тема 2. Химическая кинетика и химическое равновесие
- •2.1. Скорость химической реакции
- •2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •2.3. Зависимость скорости реакции от температуры
- •2.4. Катализ
- •2.5. Химическое равновесие
- •2.6. Смещение химического равновесия. Принцип Ле Шателье
- •2.7. Решение типовых задач
- •2.8. Задачи для самостоятельного решения
- •Тема 3. Строение атома и периодическая система элементов д.И. Менделеева
- •3.1. Первые модели строения атома
- •3.2. Квантово-механическая модель атома водорода
- •3.3. Строение многоэлектронных атомов
- •3.4. Периодическая система элементов д. И. Менделеева
- •3.5. Периодические свойства элементов
- •3.6. Решение типовых задач
- •3.7. Задачи для самостоятельного решения
- •Тема 4. Химическая связь
- •4.1. Ковалентная связь
- •4.2. Гибридизация атомных орбиталей
- •4.3. Ионная химическая связь
- •4.4. Металлическая связь
- •4.5. Водородная связь
- •4.6. Строение твердого тела
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л- объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •1. Важнейшие единицы си и их соотношение с единицами других систем
- •2. Приставки для дольных и кратных единиц си
- •3. Термодинамические характеристики некоторых веществ при 298 к
- •5. Энергия разрыва связи
- •6. Электроотрицательность элементов по Полингу
- •7. Стандартные окислительно-восстановительные потенциалы элементов
- •8. Таблица растворимости соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •9. Константы диссоциации Кд слабых электролитов
- •10. Распределение электронов в атоме
- •Список литературы
2.8. Задачи для самостоятельного решения
1. Во сколько раз следует увеличить концентрацию водорода в системе
![]() ,
,
чтобы скорость реакции возросла в 125 раз?
2. Как изменится скорость реакции
![]()
если давление в системе увеличить в два раза?
3. Реакция между оксидом азота (II) и хлором протекает по уравнению
![]() ;
;
как изменится скорость реакции при увеличении:
а) концентрации оксида азота в два раза;
б) концентрации хлора в два раза;
в) концентрации обоих веществ в два раза?
4. При 150˚С некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент равным 2,5, рассчитайте, через какой период времени закончится эта реакция при 80˚С.
5. При температуре 40˚С реакция протекает за 36 минут, а при 60˚С – за 4 минуты. Рассчитайте температурный коэффициент скорости реакции.
6. Скорость некоторой реакции при 1000С равна 1. Во сколько раз медленнее будет протекать та же реакция при 100С (температурный коэффициент скорости принять равным 2)?
7. При охлаждении реакционной смеси с 500 до 200С скорость химической реакции уменьшилась в 27 раз. Вычислите температурный коэффициент этой реакции.
8. Составьте математическое выражение константы химического равновесия для каждой из следующих реакций:
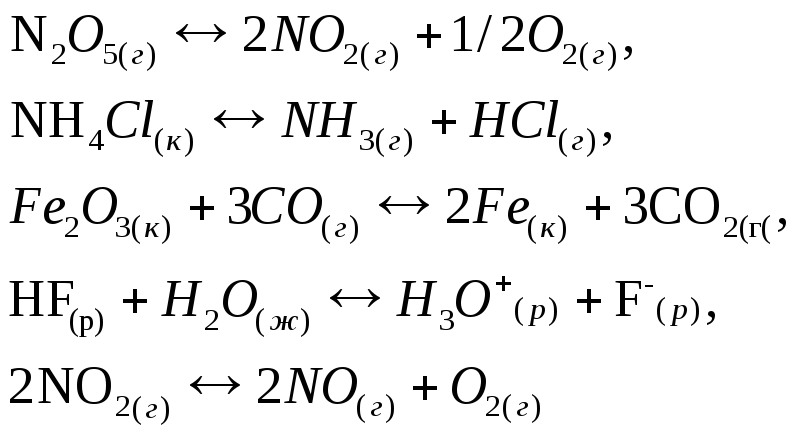
Выполняя это задание, особо обратите внимание на то, что некоторые вещества – участники реакций – находятся в твердом состоянии.
9. Вычислить константу равновесия реакции
![]()
если равновесные концентрации равны
![]() ,
,
![]() .
.
10. Примените принцип Ле Шателье для предсказания условий, которые позволяют увеличить выход нижеприведенных реакций за счет смещения равновесия:
![]() (ΔН>0);
(ΔН>0);
![]() ,
(ΔН<0);
,
(ΔН<0);
![]() ,
(ΔН<0).
,
(ΔН<0).
11. Среди приведенных реакций укажите те, для которых повышение давления смещает вправо химическое равновесие:
а)![]() ;
;
б)
![]() ;
;
в)
![]() ;
;
г)
![]() ;
;
д)
![]() ;
;
е)
![]() .
.
12. При некоторой температуре константа равновесия процесса
![]() равна 1.
равна 1.
Начальные концентрации Н2 и НСОН составляли 4 моль/л и 3 моль/л соответственно. Какова равновесная концентрация СН3ОН?
13. Реакция протекает по уравнению 2А ↔ В. Исходная концентрация вещества А равна 0,2 моль/л. Константа равновесия реакции равна 0,5. Вычислите равновесные концентрации реагирующих веществ.
14. При некоторой температуре равновесная концентрация серного ангидрида, образующегося в результате реакции
![]() ,
,
составила 0,02 моль/л. Исходные концентрации сернистого газа и кислорода составляли, соответственно, 0,06 и 0,07 моль/л. Рассчитайте константу равновесия реакции.
Тема 3. Строение атома и периодическая система элементов д.И. Менделеева
3.1. Первые модели строения атома
В 1897 г. Дж. Томсон (Англия) открыл электрон, а в 1909 г. Р. Малликен определил его заряд, который равен 1,6 · 10-19 Кл. Масса электрона составляет 9,11 ∙ 10-28 г. В 1904 г. Дж. Томсон предложил модель строения атома, согласно которой атом можно представить в виде положительной сферы с вкрапленными электронами.
В 1910 г. в лаборатории Э. Резерфорда (Англия) в опытах по бомбардировке металлической фольги α-частицами было установлено, что некоторые α-частицы рассеиваются фольгой. Отсюда Резерфорд заключил, что в центре атома существует положительно заряженное ядро малого размера, окруженное электронами. Радиусы ядер лежат в пределах 10-14 – 10-15 м, т.е. в 104 – 105 раз меньше размера атома. Резерфорд предсказал существование протона и его массу, которая в 1800 раз превышает массу электрона.
В 1910 г. Резерфорд предложил ядерную планетарную модель атома, состоящего из тяжелого ядра, вокруг которого двигаются по орбитам электроны, подобно планетам солнечной системы. Однако, как показывает теория электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро.
Атомные спектры. При нагреве вещество испускает лучи (излучение). Если излучение имеет одну длину волны, то оно называется монохроматическим. В большинстве же случаев излучение характеризуется несколькими длинами волн. При разложении излучения на монохроматические компоненты получают спектр излучения, где отдельные его составляющие выражаются спектральными линиями. На рис 3.1. приведен атомный спектр водорода. Длины волн, соответствующие атомному спектру водорода, определяются уравнением Бальмера
![]() .
(3.1)
.
(3.1)
где λ – длина волны; R – постоянная Ридберга (109678 см-1); n и m – целые числа (n = 1 для серии Лаймана, n = 2 – для серии Бальмера, n = 3 – для серии Пашена; m = 2, 3, 4 для серии Лаймана, m = 3, 4, 5 для серии Бальмера, m = 4, 5, 6 – для серии Пашена).
Кванты и модель Бора. В 1900 г. М. Планк (Германия) высказал предположение, что вещества поглощают и испускают энергию дискретными порциями, названными им квантами. Энергия кванта Е пропорциональна частоте излучения (колебания) ν:
![]() ,
,
где – h – постоянная Планка (6,626∙10-34 Дж·с); ν = с/λ, с – скорость света; λ – длина волны.
В 1913 г. датский ученый Н. Бор, испльзуя модель Резерфорда и теорию Планка, предложил модель строения атома водорода, согласно которой электроны двигаются вокруг ядра не по любым, а лишь по разрешенным орбитам, на которых электрон обладает определенными энергиями.При переходе электрона с одной ориты на другую атом поглощает или испускает энергию в виде квантов. Каждая орбита имеет номер n (1, 2, 3, 4,…), который назвали главным квантовым числом. Бор вычислил радиусы орбит. Радиус первой орбиты был 5,29∙10-13 м, радиус других орбит был равен:
![]()
Энергия электрона (эВ) зависила от значения главного квантового
числа n:
![]()
Отрицательный знак энергии означает устойчивость системы, которая тем более устойчива, чем ниже (чем более отрицательна) ее энергия. Атом водорода обладает минимальной энергией, когда электрон находится на первой орбите (n=1). Такое состояние называется основным. При переходе электрона на более высокие орбиты атом становится возбужденным. Такое состояние атома неустойчиво.
|
Рис. 3.1. Схема энергетических уровней и квантовые переходы атома водорода |
При переходе с верхней орбиты на нижнюю атом излучает квант света, что экспериментально обнаруживается в виде серий атомного спектра (рис.3.1.). Значения n и m в уравнении (3.1) соответствуют значениям главных квантовых чисел, с которых электрон переходит (m) и на которые электрон переходит (n). Теория Бора позволила рассчитать энергию электронов, значения квантов энергии, испускаемых при переходе электрона с одного уровня на другой. Теория Бора получила экспериментальное подтверждение. Однако Она не смогла объяснить поведение электрона в магнитном поле и все атомные спектральные линии. Теория Бора оказалась непригодной для многоэлектронных атомов. Возникла необходимость в новой модели атома, основанной на открытиях в микромире. |

