
Лекция № 18-19.Коллигативные свойства растворов
План
Осмос и осмотическое давление
Роль осмоса в биологических системах
Законы Рауля и следствия из них.
У растворов имеется ряд свойств, названных коллигативными, которые не зависят от природы растворенного вещества, а только от его молярной концентрации. Для бесконечно разбавленных растворов, состояние которых близко к состоянию идеальных, такими свойствами являются осмотическое давление, понижение давления насыщенного пара над раствором, повышение температуры кипения и понижение температуры замерзания раствора.
Идеальными растворами называются растворы, при образовании которых не происходит изменения энтальпии и объема системы. В идеальных растворах энергия взаимодействия между всеми компонентами одинакова. Наиболее близки к идеальным – разбавленные растворы неэлектролитов.
Изучение коллигативных свойств разбавленных растворов служит одним из наиболее распространенных способов определения молярной массы растворенного вещества, а также его степени диссоциации или показателя ассоциации.
1. Осмос и осмотическое давление
П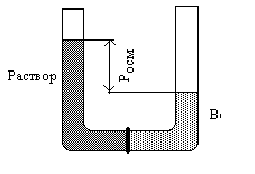 редставимU-образную
трубку, снабженную внизу полупроницаемой
перегородкой (мембраной), через поры
которой могут свободно проникать
молекулы воды (или какого-либо другого
растворителя), но не молекулы или ионы
растворенного вещества. Полупроницаемой
перегородкой может быть, например,
оболочка бычьего пузыря, целлофан,
пергамент, пленка коллодия, неглазурованные
керамика и фарфор, поры которых заполняют
(методом осаждения из растворов Си)
гексацианоферратом меди Си2[Fе(СN)б].
редставимU-образную
трубку, снабженную внизу полупроницаемой
перегородкой (мембраной), через поры
которой могут свободно проникать
молекулы воды (или какого-либо другого
растворителя), но не молекулы или ионы
растворенного вещества. Полупроницаемой
перегородкой может быть, например,
оболочка бычьего пузыря, целлофан,
пергамент, пленка коллодия, неглазурованные
керамика и фарфор, поры которых заполняют
(методом осаждения из растворов Си)
гексацианоферратом меди Си2[Fе(СN)б].
Заполним правое колено прибора чистым растворителем (водой), а левое—раствором сахарозы в воде так, чтобы вначале уровни жидкости в обоих коленах были одинаковыми. Очевидно, если бы полупроницаемой перегородки не было, то, в силу существующего в природе стремления всякой системы к максимальной неупорядоченности, нивелированию свойств, система стремилась бы к возрастанию энтропии, начался бы процесс выравнивания концентрации раствора в обеих частях прибора за счет диффузии молекул сахарозы в правую часть и встречного движения молекул воды в левую часть. Однако в данном случае диффузии молекул сахарозы в правую часть прибора препятствует полупроницаемая перегородка, и выравнивание концентраций осуществляется в одностороннем порядке, только за счет медленного перехода части молекул воды из правой части прибора в левую, где концентрация растворенного вещества выше. В итоге уровень жидкости в правом колене начнет снижаться, а в левом — возрастать, пока не установится некоторая разность гидростатических столбов, отвечающая давлению Росм, при котором эта односторонняя диффузия прекратится.
Процесс самопроизвольного перехода (диффузии) растворителя через проницаемую перегородку из той части системы, где концентрация растворенного вещества ниже, в другую, где она выше, называется осмосом. В рассматриваемом примере по достижении некоторого давления Росм (со стороны раствора) наступает подвижное равновесие: скорость диффузии воды из правого колена в левое будет уравновешена скоростью обратного перехода ее из левой части прибора в правую. Давление, которое нужно приложить к раствору, чтобы прекратить осмос, т. е. проникновение в него через полупроницаемую перегородку чистого растворителя, называется осмотическим давлением.
Осмотическое давление является мерой стремления растворенного вещества (вследствие теплового движения его молекул) перейти в процесс диффузии из раствора в чистый растворитель и равномерно распределиться по всему объему растворителя. Отрицательное изменение энергии Гиббса системы в процессе осмоса происходит главным образом за счет соответствующего изменения энтропийного фактора.
В. Пфеффер (1877) установил следующую зависимость роем от различных факторов: 1) осмотическое давление Роем изменяется прямо пропорционально концентрации растворенного вещества с (при Т = const и Роем/с = const), 2) оно изменяется прямо пропорционально абсолютной температуре Т при с = const и Росм/T== const).
Все эти факты наводили на мысль, что зависимость осмотического давления от концентрации раствора и температуры следует примерно тому же закону, что и зависимость давления газа от тех же факторов. Вант-Гофф (1887) установил закон, согласно которому
осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора.
Это значит, что осмотическое давление идеального раствора можно вычислить по уравнению Менделеева — Клапейрона рV= == RТ с той лишь разницей, что р == роем, V— объем, занимаемый раствором; — число молей растворенного вещества.
Имея в виду, что /V = с — молярная концентрация раствора, получаем уравнение, являющееся математическим выражением осмотического закона Вант-Гоффа:
![]()
Механический эффект, производимый на стенки сосуда ударами молекул газа, находящимися в тепловом движении, не тождествен эффекту, который производят на них молекулы того же вещества, находясь в растворе, где существует ближний порядок, и эти молекулы находятся в поле действия межмолекулярных сил и сил водородных связей.
Осмотическое давление обнаруживается лишь в том случае, если на пути к равномерному распределению растворенного вещества во всем объеме раствора встает полупроницаемая мембрана. При этом стремление растворенного вещества к диффузии в направлении меньших концентраций проявляется в виде одностороннего давления на полупроницаемую перегородку, поскольку давление по другую сторону этой перегородки, проистекающее от тех же самых тенденций, меньше. Таким образом, осмотическое давление не означает какое-то дополнительное механическое давление в растворителе, возникающее из-за наличия в нем растворенного вещества, а является лишь мерой стремления растворенного вещества к равномерному распределению во всем объеме растворителя, находящегося по обе стороны полупроницаемой перегородки.
Растворы, имеющие одинаковое осмотическое давление, называют изотоническими. Если некоторый раствор А имеет большее осмотическое давление, чем раствор В, то в этом случае говорят, что А гипертоничен по отношению к раствору В или что раствор В гипотоничен по отношению к раствору. А.
Исходя из уравнения, можно было бы ожидать, что растворы самых разнообразных веществ, имеющие одну и ту же молярную концентрацию, должны быть изотоническими. В действительности из-за того, что одни вещества при растворении распадаются на ионы, более простые молекулы или же в результате ассоциации образуют более сложные полимерные молекулы, а другие при этом не претерпевают изменений, растворы равной молярной концентрации не всегда оказываются изотоническими. Если учесть, что из N0 молекул растворенного вещества образуется N1 дочерних частиц, то в уравнение для расчета осмотического давления придется ввести дополнительный сомножитель i, называемый изотоническим коэффициентом Вант-Гоффа, который равен отношению числа отдельных частиц (нормальных молекул, ионов, ассоциированных или более простых дочерних молекул) N1 к общему числу молекул растворенного вещества N0) в объеме раствора.
![]()
![]()
Если из общего числа молекул растворенного вещества - часть их первоначального количества распалась на дочерних частиц (или одна молекула образует в среднем полимерных молекул), а остальная часть молекул (1 — ) остается в неизменном виде, то изотонический коэффициент Вант-Гоффа будет равен
![]()
Для бинарного электролита, распадающегося на 2 иона ( ==2), например для NаС1, i == 1 + ; для тринарного электролита ( = 3), например для СаСl2, i = 1 + 2 и т.д. Причем во всех случаях — это степень диссоциации или степень ассоциации растворенного вещества, выраженная в долях единицы.
