
Атомная физика лабораторные работы
.pdfформально получаемые с помощью векторной модели сложения, реализуются в реальных атомах. Для детального анализа возможности существования того или иного состояния нужно рассматривать более подробно строение электронной оболочки атома.
Следует отметить, что не все переходы между термами возможны. Эти переходы должны подчиняться правилам отбора. Эмпирически было установлено, что при нормальной связи в сложных атомах правила отбора для квантовых чисел L, S, J таковы:
L 0, 1; |
S 0; |
J 0, 1. |
(72) |
При этом, однако, переход J = 0 J = 0 запрещен. Указанные правила отбора обоснованы квантовой теорией и
не всегда являются достаточно жесткими. Напомним, суть этих правил в том, что только при таких изменениях квантовых чисел L, S, J вероятность переходов существенна.
Состояния атомов принято изображать графическими схемами, на которых помимо термов указываются также возможные переходы между термами и длины волн излучаемых при этом ли-
ний. По вертикальной оси откладывается энергия состояний (в электрон-вольтах 1 эВ = 1,6 10–19 Дж), причем за начало отсчёта
(за ноль энергии) принимают энергию основного состояния (рис. 29 для атома натрия).
Но на самом деле электрон в атоме не является свободным (находится в потенциальной яме), поэтому его полная энергия должна быть меньше нуля (вспомните энергетические уровни атома водорода). Таким образом, чтобы получить реальные значения энергии, ось энергии надо сдвинуть вниз на величину ионизационного потенциала энергии, которую надо сообщить валентному электрону, находящемуся на самом верхнем энергетическом уровне, чтобы он стал свободным. В случае натрия эта энергия равна Еион ~ 5,12 эВ (см. рис. 29). Получаем, что реальная энергия основного 32S1/2 терма равна Еосн = 0 – 5,12 эВ = –5,12 эВ,
а энергия терма 32 Р3/2, например, Е = 2,1 – 5,12 эВ. Энергия свободного электрона равна нулю и больше.
Спектры атомов принято делить на серии. В отличие от простейшего случая атома водорода здесь вводится несколько другая
81

классификация. Переходы с уровня Р на ближайший свободный к ядру уровень S называются главной серией. Переходы, соответствующие S Р, носят название резкой серии. Переходы D Р – диффузная серия. И наконец, переходы F D именуются фундаментальной серией.
Рис. 29. Cхема энергетических уровней атома натрия
82

Спин электрона существенно влияет на характер атомных спектров, поскольку связанный с ним магнитный момент вызывает зависимость энергии электрона в данном состоянии от ориентации S относительно L. Орбитальный механический момент импульса обусловливает магнитный момент и, следовательно, некоторое магнитное поле. Проекция спина электрона на направление напряженности этого поля, как известно, может принимать два значения, так как ms = ±1/2. Для электрона с l 0 возможны два близких состояния с j1 = l + 1/2, j2 = l – 1/2. Энергии этих двух состояний различны. Такое спин-орбитальное взаимодействие приводит к своеобразному внутреннему эффекту Зеемана даже при отсутствии внешнего магнитного поля (внутреннее поле создаёт «движение» электрона по орбите).
На рис. 30 приведена структура дублетного расщепления термов атомов щелочных металлов.
Рис. 30. Структура расщепления p, d и f уровней щелочных металлов
На рис. 31 показано Р-состояние (l = 1) атома натрия Na, которое в результате взаимодействия магнитных моментов расщепляется на два подсостояния с термами 2Р3/2 и 2P1/2. Поэтому вместо одной спектральной линии, соответствующей переходу Р S,
83

в действительности наблюдаются две близкие линии, соответст-
вующие переходам 2Р3/2 2S1/2 и 2Р1/2 2S1/2 (см. рис. 29). Именно этим объясняется дублет желтых линий 589,0 и 589,6 нм в спектре натрия.
Рис. 31. P-состояние атома натрия
Расщепление уровней с данным l из-за спин-орбитального взаимодействия носит название тонкой структуры. «Тонкой» она называется потому, что расщепление уровней мало по сравнению с расстоянием между уровнями с различными n и l. Таким образом, наличие у электронов момента спина вызывает расщепление термов (уровней) на подуровне кроме S и, как результат, расщепление спектральных линий (рис. 32).
Тонкая структура спектральной (желтой) линии, соответствующей главной серии, представлена на рис. 33.
Рис. 32. Тонкая структура некоторых уровней натрия
84

Рис. 33. Тонкая структура желтой линии натрия
Из нерелятивистской квантовой механики при решении задачи об энергии электрона многоэлектронного атома получается в первом приближении следующая формула:
|
|
|
E |
nl |
A(Z |
nl |
) |
2 |
1 |
, |
(73) |
||
|
|
|
|
n2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
||||
где |
A |
k2me4 |
13,662 эВ; m – масса электрона; Z – заряд ядра; |
||||||||||
2 2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
е – |
заряд электрона; k = 9 109. |
|
|
|
|
|
|
|
|||||
|
Здесь величину (Z nl ) |
можно рассматривать как «эффек- |
|||||||||||
тивный» заряд ядра, т.е. заряд, обусловленный положительным зарядом Z ядра и отрицательным зарядом электронной оболочки, которая как бы экранирует часть заряда ядра. Таким образом, nl имеет смысл постоянной экранировки, учитывающей взаимодействие данного электрона и с ядром, и с остальными электронами. Особенно хорошо формула (73) описывает щелочные металлы, в том числе и исследуемый в данной работе атом натрия, так как если атом щелочного металла имеет всего Z электронов, то можно считать, что Z – 1 электронов с ядром образуют относительно прочный «остов», в электрическом поле которого движется внешний (валентный электрон), довольно слабо связанный с остовом атома. Таким образом, в некотором смысле атомы щелочного металла являются водороподобными, но в отличие от формулы для энергии водородоподобного атома, формула (73)
85
показывает, что энергия зависит ещё и от квантового числа l, т.е. в данном случае вырождение по l снимается.
Пример: электронная конфигурация атома натрия (ls22s22p63s1), откуда следует, что последний электрон стоит обособленно от полностью заполненных нижних оболочек.
Релятивистская квантовая теория атома показывает, что поправка к энергии водородоподобного атома за счёт спинрелятивистских эффектов следующая:
E |
Z4 4mc2 |
3 |
n |
|
, |
(74) |
|||
|
|
|
|
|
|
|
|||
|
|
|
|
||||||
|
n4 |
|
8 |
2 j 1 |
|
|
|
||
|
|
|
|
|
|||||
где |
ke2 |
1 |
|
– постоянная тонкой струк- |
||
|
|
|
|
0,00729735 |
||
|
|
|||||
|
c |
137,03604 |
|
|||
туры; n, j – квантовые числа.
По аналогии с формулой (73) формулу (74) можно обобщить на сложные атомы, вводя поправку к заряду ядра nl, которая имеет тот же смысл, что и nl в (73). Таким образом, формула, описывающая энергетические уровни сложного атома и учитывающая релятивистские эффекты и спин-орбитальное взаимодействие, будет выглядеть следующим образом:
E |
|
A(Z |
|
) |
2 |
1 |
|
(Z nj)4 4mc2 |
3 |
|
n |
|
. (75) |
|||
nlj |
nl |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
n2 |
|
n4 |
|
8 |
|
2 j 1 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
Кроме тонкой структуры в спектрах многих атомов наблюдается также сверхтонкая структура, которая объясняется взаимодействием магнитного момента электрона со слабым магнитным полем атомного ядра, но в рамках данной работы эти поправки не рассматриваются.
В данной работе изучается тонкая структура (расщепление уровней атома, обусловленное взаимодействием спина электрона с магнитным полем, созданным орбитальным моментом) энергетических уровней атома на примере дублета желтой линии натрия. Соответствующие переходы, обусловливающие этот дублет, показаны на рис. 29 и продублированы в более понятном виде на рис. 33. Для краткости обозначим термы соответственно
86

Е0, El, E2. При переходе Е1 Е0 излучается фотон с частотой l (длинноволновая компонента желтого дублета натрия), при переходе электрона с уровня Е2 Е0 излучается фотон близкой частоты 2 (коротковолновая компонента желтого дублета натрия). Поскольку 2 > 1, то 2 < 1, и можно записать:
E2 – E0 = h 2; |
E1 – E0 |
= h 1, |
(76) |
E2 – E0 = hc/ 2; |
E1 – E0 |
= hc/ 1. |
(77) |
Вычитая из первого уравнения второе, получаем экспериментальную формулу тонкой структуры дублета:
|
1 |
|
1 |
|
|
|
|
|
(78) |
||||
|
|
|||||
E2 E1 E21эксп hc |
2 |
. |
||||
|
|
1 |
|
|
||
Воспользовавшись теоретически полученным соотношением (75) для разности энергий между соседними уровнями Е2 – Е1, можно получить следующую формулу (подробно соответствующие преобразования см. в кн.: Шпольский Э. В. Атомная физика.
СПб.: Лань, 2010. Т. 2):
E21теор |
|
(Z т.с )4 |
4mc2 |
|
1 |
, |
(79) |
n3 |
|
4 |
|||||
|
|
|
|
|
|
где поправка т.с представляет собой обобщенную справочную поправку тонкой структуры. Значения поправок и другие необходимые справочные данные приводятся далее в указаниях к выполнению работы.
Исходя из формул (78) и (79), можно получить экспериментальное значение постоянной тонкой структуры :
|
|
|
1 |
|
1 |
|
|
|
|||
|
|
h |
|
|
4n3 |
|
|||||
|
|
|
|
|
|||||||
4 |
|
|
2 |
|
|
|
|||||
|
|
|
|
1 |
|
|
|
||||
эксп |
|
|
|
|
mc |
|
|
. |
(80) |
||
|
|
Z т.с |
|
||||||||
|
|
|
|
|
|
|
|||||
87

Экспериментальная установка
Установка ЛКК-4 (рис. 34) состоит из измерительной системы 1 (ИСК-2), блока источников света 2, монохроматора 3 и зрительной трубы 4.
Рис. 34. Внешний вид установки ЛКК-4
Измерительная система ИСК-2 обеспечивает:
–питание источников света;
–задание и измерение токов и напряжений источников света;
–измерение токов фотоприемников с разрешением от 10–11 А;
–создание и измерение нужных напряжений на фотоприем-
никах;
–нагрев и термостатирование кюветы с йодом;
–создание и измерение тока электромагнита.
Блок источников светапозволяетполучить излучениеразличных источников света и содержит ртутную лампу, водородную лампу, натриевуюлампу,неоновуюлампу,лампунакаливанияисветодиод.
88
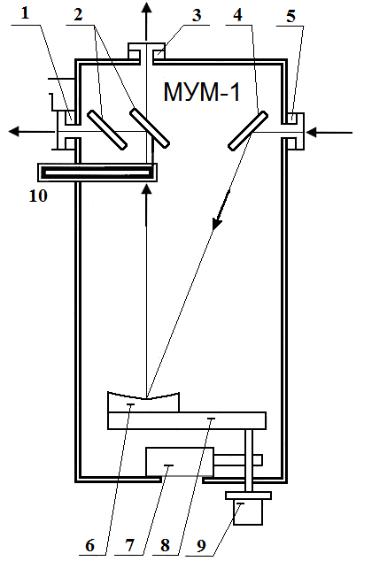
Монохроматор необходим для разложения света в спектр и содержит оптический ввод, сферическую дифракционную решетку, боковой и задний выходы излучения и механизм поворота решетки, связанный со шкалой отсчета длины волны излучения.
Зрительная труба необходима для наблюдения спектров излучения и содержит объектив, окуляр и визирный крест.
Свет от оптических источников излучения (спектральных ламп) поступает на вход (объектив) 5 монохроматора (рис. 35).
Рис. 35. Монохроматор. Вид сверху
Монохроматор (см. рис. 35) имеет сферическую дифракционную решетку 6, боковой выход 3, задний выход 1, механизм 8 по-
89
ворота решетки и связанный с ним механизм 7 отсчета длины волны излучения с приводом от вала с ручкой 9. На входе и на выходах имеется возможность устанавливать сменные щели.
Излучение, вошедшее во входную щель 5, направляется на дифракционную решетку 6 неподвижным зеркалом 4. Длина волны излучения, отраженного от решетки в направлении выхода монохроматора, зависит от ориентации решетки. Поворот решетки осуществляется вращением ручки 9.
Длина волны отсчитывается по шкале 7 отсчетного устройства. Шкала имеет три барабана, показывающие значение длины волны в нанометрах. Правый барабан имеет дополнительную шкалу с ценой деления 0,2 нм, отсчет по которой производится по горизонтальной визирной линии. Выбор выхода монохроматора осуществляется с помощью подвижного зеркала 2, перемещаемого штоком 10.
Шкала монохроматора уже откалибрована в показаниях длин волн, однако для повышения точности измерений рекомендуется провести более точную калибровку шкалы монохроматора с помощью ртутной спектральной лампы.
ВЫПОЛНЕНИЕ РАБОТЫ
1.Включите установку в сеть с напряжением 220 В. Переключатель «СЕТЬ» на блоке питания при этом должен находиться в положении «ВЫКЛ».
2.Поставьте переключатель «СЕТЬ» в положение «ВКЛ», переключатель «ЛАМПА» – в положение «Hg» (ртутная). При этом должен начаться процесс розжига дугового разряда в ртутной лампе. Дайте лампе прогреться 3–5 мин.
3.Поставьте щели, обеспечивающие возможность поиска и четкого изображения спектральных линий. Для этого рекомен-
дуется на входе зрительной трубы монохроматора поставить щели 0,05 мм в положение II (римская цифра II на щелях обращена наружу).
4. Наблюдение спектра ртути рекомендуется начинать с синей области. Вращением ручки 1 монохроматора (рис. 36) установите длинуволны435,1 нм,чтосоответствуетсинейлинииспектрартути.
90
