
- •Руководство для студентов к практическим занятиям по микробиологии
- •Этапы приготовления препарата
- •Алгоритм приготовления мазка
- •Способ грама
- •Правила иммерсионной микроскопии
- •Диагностика туберкулеза легких бактериоскопическим методом
- •Метод циля-нильсена (инструкция 1999год)
- •Метод циля-нильсена
- •Обнаружение капсул по методу бурри
- •Окраска по методу ожешко
- •Метод раздавленной капли
- •Метод висячей капли
- •2009 Год
Способ грама
На фиксированный мазок нанести генцианвиолет (бумага по Синеву) на 1-2 мин
Краску слить и нанести раствор Люголя на 1 мин
Раствор Люголя слить и на мазок нанести 96% спирт на 15-20 мин в зависимости от толщины мазка
Спирт смыть дистиллированной водой
Мазок дополнительно окрасить разведенным фуксином Пфейффера на 2-3 мин
Краситель смыть водой, препарат высушить, промикроскопировать с иммерсией
Микроскопия с иммерсией.
Генцианвиолет связывается с пептидогликаном клеточной стенки (рис. №2). Толстый слой пептидогликана грамположительных бактерий связывает много красителя, тонкий слой – грамотрицательных – мало. Раствор Люголя фиксирует краситель за счет образования комплекса – краситель-пептидогликан-йод. При обработке мазка спиртом грамотрицательные микроорганизмы быстро теряют краситель и обесцвечиваются, а грамположительные остаются окрашенными в синий цвет. Дополнительный краситель окрашивает грамотрицательные микроорганизмы в красный цвет
Грамположительные (Гр+) бактерии окрашиваются в сине-фиолетовый цвет. Грамотрицательные (Гр-) бактерии окрашиваются в красный цвет.
Рис. № 2. Грамотрицательные и грамположительные бактерии
|
Грамположительные микроорганизмы |
|
|
|
Грамотрицательные микроорганизмы |
|
|

|
|
|
|
Стрептококки Гр+ кокки, располагающиеся в виде цепочек
Streptococcus piogenes Enterococcus faecalis

Стафилококки Гр+
кокки, располагающиеся в
виде скоплений,
напоминающих
виноградную гроздь
Staphylococcus aureus Staphylococcus epidermidis
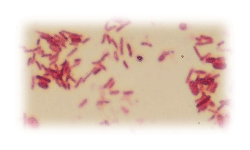
Бактерии Гр- палочковидные неспорообразующиие микроорганизмы
Esherichia coli Salmonella typhi Mycobacterium tuberculosis
|
| |
|
|
|
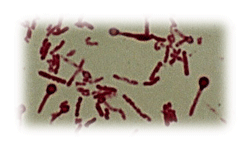
Клостридии Гр+ палочковидные спорообразующие микроорганизмы. Диаметр спор больше поперечника клетки
Clostridium perfringens Clostridium tetani Clostridium botulinum
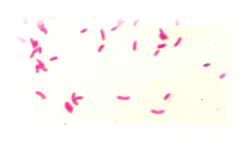
Вибрионы Гр-
Vibrio cholerae Vibrio parahaemolyticus
Правила иммерсионной микроскопии
Микроскоп устанавливают в рабочее положение – увеличение объективов
Устанавливают освещение, включая лампу или направляя свет на зеркало микроскопа. Конденсор должен быть поднят до упора, диафрагма открыта (рис. №3)
На препарат наносят каплю иммерсионного масла
Препарат помещают на предметный столик и фиксируют его клеммами
Наблюдая сбоку, опускают тубус с объективом 90х, 100х макровинтами в масло почти до соприкосновения с препаратом
Затем, глядя в окуляр (7х, 10х), макровинтом очень медленно поднимают объектив до появления изображения и с помощью микровинта производят окончательную фокусировку четкого изображения
При микроскопии определяют взаимное расположение микроорганизмов, их размеры, форму, структуру, окраску
После просмотра препарата револьвер переводят на малое увеличение 8х и только после этого препарат снимают со столика
Фронтальную линзу объектива протирают марлей, смоченной чистым бензином или эфиром для удаления остатков иммерсионного масла
Затем опускают предметный столик (или конденсор в микроскопах с неподвижным столиком) и накрывают микроскоп чехлом.
Р

 ис.
№3.Рабочие
положения микроскопов
ис.
№3.Рабочие
положения микроскопов
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №2
Окраска кислотоустойчивых бактерий по методу Циля-Нильсена.
Студент должен иметь представления:
- этапы развития микробиологии как науки,
- разделы медицинской микробиологии.
Студент должен знать:
- задачи медицинской микробиологии,
- вклад ученых на разных этапах развития,
- основные формы микроорганизмов, их характеристика, примеры,
- главные структуры бактериальной клетки, их функции,
- цель применения и сущность метода Циля - Нильсена, цель подогревания препарата
Студент должен уметь:
- особенности подготовки нативного препарата с мокроты,
- окраска препарата по методу Циля – Нильсена,
-микроскопия окрашенных препаратов с использованием иммерсионной системы,
- соблюдение мер безопасной работы с инфекционным материалом,
- обработка рабочего места и рук дез. веществами.
Этапы самостоятельной аудиторной работы:
Подготовить препарат из культуры и окрасить его по методу Циля- Нильсена 2-мя способами
Препараты, подготовленные и демонстрационные, промикроскопировать с иммерсией.
Обработать рабочие места и руки
Зарисовать результаты микроскопирования в дневник


