
- •Глава 1. Атомно-кристаллическое строение материалов
- •1. Электронное строение атомов. Классификация элементов в периодической системе д. И. Менделеева
- •2. Кристаллическое строение твердых тел
- •3. Типы связей между атомами (молекулами) в кристаллах
- •Пояснения к ответам на вопросы
- •2) Правильно.
- •Глава II. Основы теории кристаллизации
- •1. Энергетические условия кристаллизации
- •2. Механизм процесса кристаллизации
- •3. Размер зерна, образующегося при кристаллизации. Строение кристаллического слитка
- •4. Дефекты строения реальных металлов
- •5. Полиморфные превращения металлов
- •6. Методы изучения кристаллического строения металлов
- •Пояснения к ответам на вопросы
- •Глава III. Механические свойства металлов
- •1. Свойства, определяемые при статических испытаниях.
- •2. Свойства, определяемые при динамическом нагружении
- •3. Свойства, определяемые при циклически действующих нагрузках (усталость материалов)
- •4. Свойства, определяемые нагружением в условиях повышенных температур
- •Глава IV. Физическая сущность механизмов деформации и разрушения металлов
- •1. Механизм упругой и пластической деформации металлов
- •3. Факторы, влияющие на хрупкое и вязкое состояние металлов
- •4. Основные направления повышения прочности металлов. Конструктивная прочность
- •Глава V. Наклеп, возврат и рекристаллизация металлов и сплавов
- •1. Наклеп металла
- •2. Отдых (возврат) металла
- •3. Рекристаллизация
- •4. Полигонизация
- •1). Совершенно правильно.
- •3). Ошибаетесь.
- •3). Совершенно правильно.
- •1). Ответ неточный.
- •2). Совершенно правильно.
- •1). Ответ неполный.
- •2). Совершенно правильно.
- •3). Правильно.
- •Глава VI. Строение и свойства сплавов
- •1. Металлические сплавы
- •Характеристика основных фаз в сплавах
- •Особенности кристаллизации сплавов
- •2. Диаграммы состояния сплавов
- •3). Совершенно правильно.
- •2). Правильно.
- •3). Совершенно правильно.
- •2). Правильно.
- •2). Совершенно правильно.
- •3). Правильно.
- •3). Правильно.
- •1). Правильно.
- •3). Правильно.
- •Глава VII. Сталь и чугун
- •1. Диаграмма состояния Fe—Fe3c
- •Глава VIII. Углеродистые стали
- •1. Влияние состава на свойства стали
- •2. Технологические свойства стали
- •3. Основы легирования стали
- •4. Фазы, образуемые легирующими элементами с железом. Влияние легирующих элементов на температуру полиморфных превращений железа.
- •Карбидообразующие легирующие элементы и типы образуемых карбидов
- •5. Влияние легирующих элементов на содержание углерода в перлите, температуру эвтектоидного превращения и свойства стали
- •6. Классификация и маркировка сталей
- •Глава IX. Чугуны
- •1. Процесс графитизации чугунов
- •2. Серый чугун
- •3. Высокопрочный чугун с шаровидным графитом
- •4. Ковкий чугун
- •Марки, основные механические свойства и структуры серых, ковких и высокопрочных чугунов (выборка)
Особенности кристаллизации сплавов
Кристаллизация
сплавов подчиняется тем же закономерностям,
как и кристаллизация чистых металлов:
![]() .
Существенным различием является большая
роль диффузионных процессов между
жидкостью и кристаллизующейся фазой
при кристаллизации сплавов, что необходимо
для перераспределения разнородных
атомов, равномерно распределенных в
жидкой фазе. В сплавах (в твердом
состоянии) могут иметь место процессы
перекристаллизации, обусловленные не
только полиморфными превращениями
компонентов сплава, но и распадом твердых
растворов, выделением из них вторичных
фаз, когда растворимость компонентов
в твердом состоянии с изменением
температуры меняется. Они называются
фазовыми превращениями в твердом
состоянии и также сопровождаются
диффузионными процессами, сильно
замедляющимся при понижении температуры.
Весьма часты случаи, когда после
охлаждения сплавы оказываются в
неравновесном состоянии.
.
Существенным различием является большая
роль диффузионных процессов между
жидкостью и кристаллизующейся фазой
при кристаллизации сплавов, что необходимо
для перераспределения разнородных
атомов, равномерно распределенных в
жидкой фазе. В сплавах (в твердом
состоянии) могут иметь место процессы
перекристаллизации, обусловленные не
только полиморфными превращениями
компонентов сплава, но и распадом твердых
растворов, выделением из них вторичных
фаз, когда растворимость компонентов
в твердом состоянии с изменением
температуры меняется. Они называются
фазовыми превращениями в твердом
состоянии и также сопровождаются
диффузионными процессами, сильно
замедляющимся при понижении температуры.
Весьма часты случаи, когда после
охлаждения сплавы оказываются в
неравновесном состоянии.
При перекристаллизации в твердом состоянии образуются центры кристаллизации, и происходит их рост. Обычно центры кристаллизации возникают по границам зерен старой фазы, где решетка имеет наиболее дефектное строение и где имеются примеси, которые могут стать центрами новых кристаллов. При возникновении новой фазы соблюдается принцип кристаллографического соответствия: на кристаллографической плоскости старых кристаллов начинается образование тех кристаллографических плоскостей новых кристаллов, строение которых наиболее близко к строению плоскости старых кристаллов. Такими плоскостями при превращении решеток Fe (о.ц.ж.) Fe (г.ц.к.) являются плоскости (110) решетки о.ц.к. и (111) решетки г.ц.к.
У старой и новой фазы в течение некоторого времени имеются общие плоскости. Такая связь решеток называется когерентной связью. В случае различия строения кристаллов старой и новой фаз превращение протекает с образованием промежуточных фаз (правило ступеней). Нарушение когерентности и обособление кристаллов наступает, когда они приобретут определенные размеры.
№ 65. Какие атомы в сплавах должны диффундировать успешнее? Ответ (см. на с. 62): атомы, образующие 1) твердые растворы внедрения; 2) твердые растворы замещения.
Чтобы понять многие особенности таких систем как сплавы, необходимо уметь пользоваться правилом фаз.
№ 66. Чем отличаются температуры кристаллизации двухкомпонентных сплавов от кристаллизации чистых веществ? Как это доказать? Ответ (см. на с. 62): кристаллизация сплавов происходит 1) при t const, при кристаллизации число степеней свободы С0; 2) в тех же температурных условиях, что и чистых веществ, С=0; 3) при других температурных условиях, сплавы — двухкомпонентные системы.
№ 67. Возможна ли кристаллизация двухкомпонентного сплава при постоянной температуре? Если да, при каких условиях? Ответ (см. на с. 62): 1) невозможна; 2) возможна, если при кристаллизации образуются две твердые фазы; 3) возможна, если при температуре кристаллизации существуют три или больше фаз.
2. Диаграммы состояния сплавов
Понимание процессов, происходящих в сплавах, на основе геометрического образа - диаграммы состояния (фазового равновесия) сплавов требует глубокого осмысливание материала. Учащийся должен по диаграмме состояния научиться:
устанавливать характер равновесных фаз и структуры в сплавах при различных температурах;
предсказывать какие изменения в строении сплавов могут иметь место при неравновесных условиях кристаллизации и охлаждения, основываясь на знаниях факторов, влияющих на процессы кристаллизации и перекристаллизации;
понимать, чем обусловлены важнейшие механические (прочность, пластичность) и технологические свойства сплавов в соответствующем фазовом и структурном состоянии.
Методика построения диаграмм состояния (фазового равновесия) сплавов, определение состава и количества фаз по диаграммам состояния.
Диаграмма состояния представляет собою графическое изображение зависимости температур фазовых превращений в сплавах от их состава.
№ 68. Исходя из данного определения, установите, в каких координатах должна строиться диаграмма состояния двухкомпонентного сплава? Ответ (см. на с. 62) в координатах: 1) температура - концентрация (состав); 2) температура — время.
Рассмотрим методику построения диаграммы состояния, например, для сплавов системы медь—никель термическим методом. Для установления температур фазовых превращений (критических точек) сплавов необходимо выполнить следующие операции.
Приготовить ряд сплавов, например, /, //, ///, IV, V, состав которых отмечен на рис. 59б (в данном случае / и V являются компонентами системы Сu и Ni).
Расплавить сплавы и провести их медленное охлаждение, фиксируя понижение температуры от времени охлаждения.
построить кривые охлаждения каждого сплава, которые представлены на рис. 59а.
Изучение фазового состояния сплавов /, //, ///, IV, V при температурах выше /, Г, 1", 1'", 2 показывает, что все сплавы находятся в жидком состоянии. При температуре 1 — медь, 2 — никель и в интервале температур /' — 2' ÷ 1"' — 2"', сплавы находятся в двухфазном состоянии. Имеют место жидкая фаза «ж» и кристаллы, которые для сплавов условно обозначены «а». При температурах ниже 1, 2', 2", 2'", 2 сплавы находятся в однофазном кристаллическом состоянии. Очевидно температуры точек 1, 2', ... 2"'', 2 — являются температурами конца кристаллизации сплавов данной системы. Температуры начала и конца фазовых превращений называются критическими.
д
 алее
следует перенести полученные критические
температуры (точки) на ординаты
соответствующих сплавов, рис. 59б;
алее
следует перенести полученные критические
температуры (точки) на ординаты
соответствующих сплавов, рис. 59б;соединив точки, имеющие одинаковую физическую сущность, линиями, получить диаграммы состояния системы медь-никель.
Кривая 1.1', ... , /'", 2, характеризующая температуры, выше которых сплавы находятся в жидком состоянии, называется линией ликвидус. Кривая 1, 2',..., 2"', 2, соответствующая температурам, ниже которых сплавы находятся в твердом состоянии, называется линией солидус. На рис. 59, б показаны схемы кристаллических решеток рассмотренных сплавов /, //, ///, IV, V Сu—Ni (черные кружки — атомы меди, белые — атомы никеля).
Следует отметить, что при построении диаграмм состояния, кроме термического метода часто приходится использовать более тонкие методы исследований (микроструктурные рентгеновские, химические и другие методы). Это особенно необходимо для сложных сплавов, имеющих различные фазовые превращения в твердом состоянии (см., например, рис. 195, 196). Большое значение при контроле правильности построенных диаграмм состояния имеет правило фаз Гиббса.
Определение состава фаз по диаграмме состояния. По диаграмме состояния можно установить, является ли образующаяся кристаллическая фаза твердым раствором, химическим соединением или чистым компонентом. Для этого нужно научиться по диаграммам состояния определять состав фаз.
На рис. 60 показана диаграмма состояния системы с компонентами А и В аналогичная диаграмме состояния системы Cu-Ni. (пока не надо обращать внимание на правую часть диаграммы).
Рассмотрим процесс кристаллизации сплава I состава точки т рис. 60. Кристаллизация начинается при температуре t1 в точке т. Казалось бы, что состав кристаллов, образующихся при кристаллизации сплава I, должен соответствовать составу сплава, т. е. т'. Но это не соответствует действительности, т.к. при равновесной кристаллизации из жидкости состава т' должны образовываться кристаллы такого состава, находящиеся жидкостью в равновесии при данной температуре t1. Состав кристаллов в данном случае будет п' - только кристаллы данного состава, взятые как самостоятельные, при температуре t1 находятся в твердом состоянии.
При температуре t2 у сплава I в точке k в равновесии находятся кристаллы состава р' и жидкая фаза состава q' (только сплав состава q' при t2 полностью расплавится). При t3 в точке и состав твердой фазы r', жидкой — l' и т. д.
С остав
жидкой и твердой фазы в двухфазной
области можно установить, основываясь
на термодинамической трактовке фазовых
превращений. Рассмотрим сплавI
(рис.
60) при температуре t2,
когда
сосуществуют две фазы: жидкость «ж»
и
-кристаллы.
остав
жидкой и твердой фазы в двухфазной
области можно установить, основываясь
на термодинамической трактовке фазовых
превращений. Рассмотрим сплавI
(рис.
60) при температуре t2,
когда
сосуществуют две фазы: жидкость «ж»
и
-кристаллы.
На
рис. 61, подобно рис. 11, показаны схемы
изменения изобарного потенциала G
при
t2
для
этих фаз (Gж
и G)
в
зависимости от состава сплавов. На рис.
61 видно, при t2,
практически
минимальным значением изобарного
потенциала G
обладает
жидкая фаза состава q'
и
твердая фаза состава р'.
Только
такого состава смесь ж
и
а
существовать
при температуре t2
может.
Изменение изобарного потенциала
двухфазной смеси а+ж
при
температуре t2
опред еляется
прямойqp.
Для
других температур состав фаз ж
и
а будет
другим.
еляется
прямойqp.
Для
других температур состав фаз ж
и
а будет
другим.
Из изложенного вытекает правило, что для определения равновесного состава фаз в двухфазной области диаграммы состояния в заданной точке, называемой фигуративной, необходимо через эту точку провести горизонтальную линию (именуемую конодой) до пересечения с линиями ликвидус и солидус диаграммы состояния. Проекция точки пересечения коноды с линией ликвидус на концентрационную ось определяет состав жидкой фазы. Проекция точки пересечения коноды с линией солидус на концентрационную ось определяет состав твердой фазы.
Соотношение фаз при кристаллизации непрерывно изменяется, но при равновесной кристаллизации диффузионные процессы успевают выровнять состав фаз в соответствии с диаграммой состояния. Например, при tз состав как ранее выпавших кристаллов, так и при этой температуре кристаллизующихся, соответствует точке r'.
Если бы мы умели рассчитать и построить кривые зависимостей Gж = f(c) и GT=f(c) (с - концентрация) для изучаемой системы при разных температурах, то могли бы теоретически построить диаграмму состояния. Пока сделать это трудно - отсутствуют зависимости термодинамических характеристик сплавов от их состава с.
№ 69. Каков состав кристаллов после равновесной кристаллизации сплава I, рис. 60? Ответ (см. на с. 63): состав кристаллов 1) переменный в интервале концентрации п' ÷ т'; 2) постоянный, соответствует составу т' сплава I.
Здесь и далее мы будем говорить для краткости об изменении состава фаз по соответствующим линиям диаграммы. Состав кристаллизующейся фазы с понижением температура непрерывно изменяется по линии солидус (рис. 60). Нужно помнить, что установить действительный состав фаз можно только, проецируя соответствующие точки линий диаграммы на ось концентрации. Состав кристаллизующейся фазы (рис. 59 и 60) переменный, поэтому данная фаза есть твердый раствор.
Диаграммы состояния систем A—В (рис. 60) и Сu—Ni (рис. 59) соответствуют случаю полной растворимости компонентов сплава как в жидком, так и в твердом состоянии.
Твердые растворы на диаграммах состояния обозначают малыми буквами греческого алфавита, (а, ,,), жидкую фазу - буквой ж, или L. Поле диаграммы состояния линиями ликвидус и солидус разделяются на фазовые области ж, ж+а и а (рис. 60 и 59).
№ 70. Каков состав -кристаллов сплава /// (рис. 59) в точке а? Ответ (см. на с. 63): 1) 65% Ni и 35% Сu; 2) 75% Ni и 25% Сu; 3) 75% Сu и 25% Ni.
Определение количества фаз. Задача определения количества при любой температуре сплава в двухфазной области решается путем рассуждений.
Пусть требуется определить количество жидкой фазы ж и твердой фазы а при температуре точки k сплава / (рис. 60). Если принять общее количество сплава за единицу, а количество твердой фазы (а-кристаллов) обозначить через х, то количество жидкой фазы будет (1—х). В сплаве / имеется Ат' % компонента В, который при температуре точки k распределяется между жидкой и твердой фазами.
№ 71. Как определить количество компонента В в твердой и жидкой фазах при температуре t2 в сплаве / (рис. 60)? Ответ (см. на с. 63): количество компонента В 1) в жидкой фазе соответствует отрезку Aq', в твердой фазе — Ар'; 2) в жидкой фазе соответствует отрезку Aq', в твердой фазе; 3) в жидкой и твердой фазе равно отрезку Am'.
Составим уравнение относительно компонента В, количество которого во взятом сплаве / определяется отрезком Am'. Его количество в твердой фазе хАр', а в жидкой фазе (1—x)Aq'. Тогда
![]()
но
![]()
следовательно
(1) ![]() и(2)
и(2)
![]()
Из зависимостей (1) и (2) следует формулировка правила для определения количества фаз в двухфазовых областях.
Для определения весового или объемного количества фазы в заданной точке нужно провести через эту точку коноиду и разделить длину отрезка противолежащего составу данной фазы на общую длину коноиды.
№ 72. Для Сu и Ni (рис. 59а) на кривых охлаждения при температуре кристаллизации появляется площадка. Для сплавов //, ///, IV Сu—Ni при температуре конца кристаллизации (точки 2', 2", 2'") имеется только перегиб. Чем можно объяснить это различие? Используйте для объяснения правило определения количества фаз. Ответ (см. на с. 63): при кристаллизации 1) Сu и Ni при температурах 1 и 2 кристаллизуется вся жидкая фаза и выделяется много тепла; в сплавах //, ///, IV при температурах 2', 2", 2'" кристаллизуется последняя капля жидкости, точнее жидкой фазы при этих температурах больше нет; 2) в этих сплавов при отмеченных температурах кристаллизуется различное количество жидкой фазы; 3) имеем дело с чистыми металлами и сплавами, условия, кристаллизации которых, принципиально различны.
Диаграммы состояния для случая неограниченной растворимости компонентов в жидком и твердом состояниях
Такими диаграммами являются диаграммы состояния систем: Сu—Ni (рис. 59) и А—В (рис. 60), т.к. образующийся твердый раствор а является устойчивым при всех концентрациях сплавов, а состав твердого раствора определяется составом сплава.
Температура
кристаллизации сплавов (рис. 60) либо
повышается с увеличением В
по
отношению к А,
либо понижается с прибавлением А
к
В;
в
первом случае величина отношения
 а во втором -
а во втором -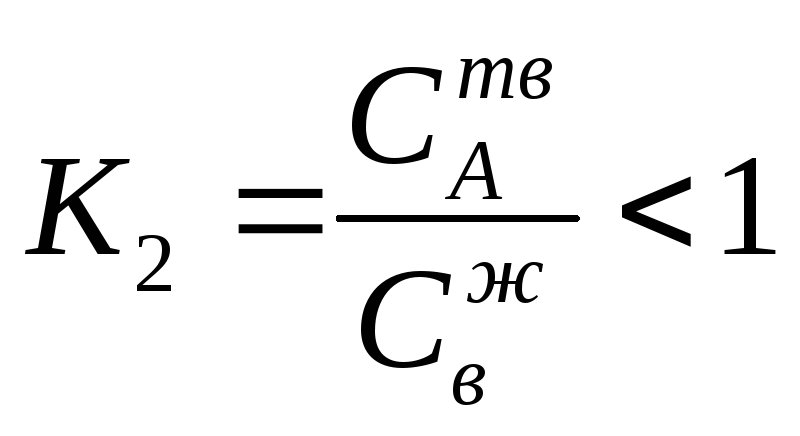 ,
где СBтв
и Сатв,
Свж
и САж
- концентрации А
и В
в твердой и жидкой фазах. Величины К1
и
К2
называются
коэффициентами распределения.
,
где СBтв
и Сатв,
Свж
и САж
- концентрации А
и В
в твердой и жидкой фазах. Величины К1
и
К2
называются
коэффициентами распределения.
Во всех системах, когда К1 > 1 и К2 < 1 ход линий ликвидус и солидус подобен диаграммам состояния Сu—Ni и А—В (рис. 59 и 60).
Однако
не во всех системах изменение K1
и
К2
имеет
подобный характер. Так для системы
Fe—Сг
(рис. 86б).
 и
и .
В этом случае линии ликвидус и солидус,
идущие слева и справа, снижаются и при
каком-то составе сливаются, давая общую
точку минимума.
.
В этом случае линии ликвидус и солидус,
идущие слева и справа, снижаются и при
каком-то составе сливаются, давая общую
точку минимума.
№ 73. Как должны идти линии солидус и ликвидус, если К1>1 и К2>1? Ответ (см. на с. 63): как в случае системы 1) А—В (рис. 60); 2) Fe—Сr (рис. 86б); 3) эти линии от чистых компонентов должны идти в сторону повышения и при слиянии дать точку максимума.
Как Вы установили из задачи 11 и по рис. 86б, не всегда диаграммы для сплавов с неограниченной растворимостью похожи на рассмотренные диаграммы (рис. 59 и 60).
При изучении следующих параграфов не спешите, особенно в целях экономии Вашего времени. Материал этих параграфов — ключ к пониманию диаграмм состояния сплавов. У Вас не должна оставаться неясной ни одна мелочь (мелочей здесь нет)!
Диаграммы состояния для сплавов, компоненты которых ограниченно растворимы в твердом состоянии,
В ряде систем, например: Аu—Ni, Аu—Сu или А—В (рис. 62), при кристаллизации жидкой фазы может образоваться неограниченный твердый раствор а, который при охлаждении, начиная с некоторой температуры (t1 рис. 62) при дальнейшем охлаждении распадается на смесь двух твердых растворов (а1 и а2), подобно рассмотренному (рис. 61).
Распад
твердого раствора а
на
смесь (а1+а2)
растворов
можно объяснить только тем, что![]() приt
<
ta
(рис. 62),
т.к.
энтропийный член TS
в
уравнении
приt
<
ta
(рис. 62),
т.к.
энтропийный член TS
в
уравнении
![]() и
энтропия
и
энтропия
![]() .
Легкие доказать (рекомендуется
проделать это самостоятельно),
что температуру распада t1
твердого
раствора а
можно
определить из зависимости
.
Легкие доказать (рекомендуется
проделать это самостоятельно),
что температуру распада t1
твердого
раствора а
можно
определить из зависимости
![]() .
.
Полезно
отметить, что энтропия различных фазовых
состояний, возможных в сплавах, убывает
по мере роста беспорядка в расположении
атомов в последовательности:
![]()
Проведя анализ фазовой диаграммы рис. 62 подобный приведенному выше для диаграммы рис. 60 при, можно показать, что при t2 состав фазы 1, должен соответствовать точке р', состав фазы 2 — точке r', т.е. здесь также реализуется выведенное правило для определения состава фаз.
Д иаграмма
состояния для сплавов с эвтектическим
превращением.Этот
вид диаграммы имеет место в случае, если
коэффициенты распределения К1<1
и К2<1
(рис. 62), и когда двухфазная смесь
образуется при температуре выше точки
т
(рис. 62), т.е. не в результате распада
твердого раствора, а из жидкого раствора
непосредственно при кристаллизации
жидкости (рис. 63).
иаграмма
состояния для сплавов с эвтектическим
превращением.Этот
вид диаграммы имеет место в случае, если
коэффициенты распределения К1<1
и К2<1
(рис. 62), и когда двухфазная смесь
образуется при температуре выше точки
т
(рис. 62), т.е. не в результате распада
твердого раствора, а из жидкого раствора
непосредственно при кристаллизации
жидкости (рис. 63).
Диаграмма состояния в последнем случае примет вид подобный рис. 63. В этом случае образовавшаяся при кристаллизации жидкости смесь твердых растворов обозначена а+. Жидкая фаза обозначается в литературе также буквой L. Поэтому, чтобы выработать привычку к такому обозначению, на данной диаграмме жидкая фаза обозначена L.
П оявление
горизонтального участка на диаграмме
(рис. 63) не удивительно: в процессе
превращения
оявление
горизонтального участка на диаграмме
(рис. 63) не удивительно: в процессе
превращения![]() сосуществуют
3 фазы. Согласно правилу
фаз
Гиббса сосуществование возможно только
в условиях, когда число степеней свободы
С=0 (С=К-Ф+1=2-3+1=0).
Значит, процесс должен реализовываться
в условиях, когда t=const
и концентрация фаз CL=const,
Ca=const
и C=
const.
Для диаграммы на рис. 63, эти параметры
следующие: t=t2
СL=Е',
Са=Q,
C
= N.
Таким образом, линия
FEH
должна
быть горизонтальной.
сосуществуют
3 фазы. Согласно правилу
фаз
Гиббса сосуществование возможно только
в условиях, когда число степеней свободы
С=0 (С=К-Ф+1=2-3+1=0).
Значит, процесс должен реализовываться
в условиях, когда t=const
и концентрация фаз CL=const,
Ca=const
и C=
const.
Для диаграммы на рис. 63, эти параметры
следующие: t=t2
СL=Е',
Са=Q,
C
= N.
Таким образом, линия
FEH
должна
быть горизонтальной.
На практике приходится пользоваться, главным образом, готовыми диаграммами состояния. Для того, чтобы научиться читать диаграммы состояния проведем разбор готовой диаграммы, отмечая при этом особенности превращений, свойственные сплавам. Методика является универсальной, и Вы сможете разобрать любую диаграмму, какой бы сложной она ни была, пользуясь данной методикой.
Важнейшим условием понимания диаграммы состояния является вдумчивое изучение текста, сопоставление её с рисунками и логическое мышление. Очень чётко нужно помнить характерные особенности основных фаз в сплавах, уметь безошибочно пользоваться правилами для определения состава и количества фаз.
Линии диаграммы делят ее на ряд фазовых областей. Чтобы установить природу фаз в этих областях, необходимо разобраться в физической сущности процессов, протекающих в сплавах при температурах, соответствующих линиям диаграммы. Для определения характера фаз по диаграмме состояния будем оперировать с основными фазами в сплавах, которыми являются твердые растворы, химические соединения и чистые компоненты, помня при этом, что чистые компоненты и химические соединения имеют постоянный, а твердые растворы - переменный состав. Верхняя линия CED диаграммы является линией ликвидус, а следующая за ней линия CFHD — линия солидус. Природу остальных линий установим по ходу разбора типовых сплавов /, //, ///, IV, V, VI. Кривые охлаждения этих сплавов приведены на рис. 63б.
Сплав /. На рис. 63б представлена кривая охлаждения сплава и схемы фазовых состояний при различных температурах сплава. Кристаллизация сплава начинается при температуре точки 11.
№ 74. Каков состав твердой фазы в точке а сплава /? Ответ (см. на с. 63): соответствует проекции точки 1) а”; 2) Ь; 3) с.
По мере кристаллизации состав твердой фазы непрерывно изменяется по линии солидус CF. Значит - кристаллизующаяся фаза есть твердый раствор, который обозначим а. Очевидно, во всей области CFE фазовый состав сплавов будет L+а. При температуре 21 кристаллизация сплава / заканчивается, и ниже температуры 21 охлаждается однофазный сплав, состоящий из кристаллов твердого раствора а.
Установив характер фазы сплава / ниже температуры 21 мы определили тем самым и фазу, устойчивую во всей области ACFK, которой будут -кристаллы. Твердый раствор а представляет собой раствор компонента В в растворителе А. Линия FK показывает, как изменяется предельная растворимость компонента В в -твердом растворе при температурах ниже t2.
Сплав VI. Кристаллизация происходит в температурном интервале 16 — 26. Легко видеть, что кристаллизация сплава VI в интервале температур 16 — 26 не имеет принципиальной разницы по сравнению с кристаллизацией сплава /.
В процессе кристаллизации образуется твердая фаза, состав которой изменяется по линии DH; поэтому её следует считать твердым раствором. Состав этого твердого раствора при равных температурах, например t1 отличен от состава твердого раствора а. Поэтому при кристаллизации сплава VI образуется другой твердый раствор, в котором растворителем является компонент В, а растворенным веществом — компонент А. Обозначим этот твердый раствор .
При температуре 26 кристаллизация сплава VI заканчивается и ниже температуры 26 имеем однофазный твердый раствор кристаллов . Во всем поле диаграммы NHDB будут кристаллы только твердого раствора . Линия HN показывает предельную растворимость компонента А в -фазе при температурах ниже t2, которая в данном случае не изменяется.
Сплав IV. Данный сплав пересекает одну линию диаграммы. Поэтому, очевидно, на кривой охлаждения у сплава должна быть одна критическая точка, что означает, что сплав IV кристаллизуется при постоянной температуре.
№ 75. Какие фазы и какого состава могут существовать при температуре t2? Ответ (см. на с. 64) фазы: 1) , состава Q; состава N; 2) , состава Е'; состава N; 3) , состава Q; , состава N; L, состава Е'.
При температуре t2 в точке Е в качестве твердых фаз будут фигурировать -кристаллы состава Q и -кристаллы, состава N. Точка Е находится на линии солидус, т.е. жидкий расплав состава Е' может кристаллизоваться только в смесь двух этих фаз а и , и не в одну из них по отдельности, так как составы этих фаз разные.
Механизм кристаллизации можно представить себе следующим образом. В жидком расплаве имеются концентрационные флуктуации. Допустим, что в некотором микрообъеме (при достижении сплавом температуры t2(l4)), состав сплава близок к значению Q. Благодаря этому создается возможность образования зародыша -кристалла. При росте -кристалла богатого компонентом А окружающая жидкость обогащается компонентом В и при достижении ею состава N создаются условия образования зародыша -кристалла. Рост кристаллов вызывает обеднение окружающего расплава компонентом В и, при достижении состава Q, вновь возникают зародыши -кристаллов и т.д. Процесс превращения жидкой фазы состава Е' в смесь двух твердых фаз а и идёт до тех пор, пока не будет израсходована вся жидкая фаза.
Смесь
двух твердых фаз, образующаяся при
кристаллизации жидкой фазы постоянного
состава (точки Е')
при
постоянной температуре (t2),
называют эвтектикой, а превращение
такого типа – эвтектическим, и схематично
его записывают
![]() .
.
№ 76. Чему равно число степеней свободы сплава при кристаллизации эвтектики? Ответ (см. на с. 64): 1) 1; 2) 2; 3) 0.
Так как при кристаллизации эвтектики одновременно кристаллизуется вся жидкая фаза, то выделяется значительное количество тепла и на кривой охлаждения образуется площадка (кривая охлаждения IV на рис. 63б). Ниже температуры t2 сплав будет двухфазным, состоящим из а- и -кристаллов. В области KFHN могут быть только фазы а+. Это вытекает из правила фаз, согласно которому (вспомним) три фазы могут сосуществовать только при температуре горизонтальных линий диаграммы состояния.
Итак, фазовый состав в различных областях диаграммы состояния следующий:
выше линии CED жидкая фаза L;
в области CEF фазы L+a;
в области DEH фазы L+;
в области ACFK фаза а;
в области NHDB фаза ;
в области KFHN фазы а+;
на линии FEH фазы L, а и .
Сплав //. При температуре 12 начинается и при температуре 22 заканчивается кристаллизация сплава образованием кристаллов -твердого раствора, как и у сплава /. После окончания кристаллизации при температуре 22 идет охлаждение -фазы до температуры 32, которая находится на линии FK диаграммы. При температуре 32 твердый раствор а еще может растворить входящий в состав сплава компонент В в количестве АII', но раствор а предельно насыщен. При более низких температурах растворимость компонента В в -твердом растворе меньше, чем количество компонента В в сплаве. Поэтому при дальнейшем охлаждении от температуры точки 32 из -твердого раствора будет выделяться фаза, способная поглотить избыток компонента В в сплаве. Этой фазой в данном случае может быть только -фаза, так как в области KFHN сосуществуют только фазы а и . Так как -кристаллы выделяются не из жидкой, а из твердой -фазы, то их принято обозначать II-кристаллы (вторичные -кристаллы). Они обычно выделяются в виде оторочки вокруг кристаллов основной -фазы (схема структуры на рис. 63б).
Сплав ///. Кристаллизация сплава начинается при температуре I3 выделением кристаллов а.
№ 77.
Каковы состав и количество жидкой фазы
L
у
сплава /// при температуре сплава t2
(23)?
Ответ
(см. на с. 64) состав соответствует: 1) точке
///' и количество
![]() ;
2) точке Е'
и
;
2) точке Е'
и
![]() ;
3) отношению
;
3) отношению![]() количествоЕ'.
количествоЕ'.
При
температуре t2
(23)
кристаллизация
заканчивается. Однако в отличие от
сплавов I
и
II
при
температуре t2,
у
сплава /// кристаллизуется значительное
количество жидкой фазы
![]() ,
или
в данном случае около 30% от общего
количества сплава. Состав этой жидкости
соответствует точке Е',
т.е.
такой же, как у сплава IV.
В
результате кристаллизации образуется
эвтектика, т.е.
,
или
в данном случае около 30% от общего
количества сплава. Состав этой жидкости
соответствует точке Е',
т.е.
такой же, как у сплава IV.
В
результате кристаллизации образуется
эвтектика, т.е.
![]() .
.
№ 78. Что будет на кривой охлаждения сплава /// при температуре 23? Ответ (см. на с. 64): 1) перегиб; 2) площадка.
При
дальнейшем охлаждении сплава /// от
температуры 23
из -кристаллов
будет выделяться II-кристаллы,
как у сплава //, так как растворимость
компонентов В
в
-твердом
растворе уменьшается в соответствии с
линией FK
диаграммы.
После полного охлаждения в сплаве /// а-
и
-фазы
присутствуют в виде следующих структурных
составляющих; -кристаллы,
эвтектика
![]() и
вторичные кристаллы II,
как это схематично показано около кривой
охлаждения сплава ///.
и
вторичные кристаллы II,
как это схематично показано около кривой
охлаждения сплава ///.
Форма
кристаллов, в виде которых находятся
разные фазы в сплаве, называется
структурой сплава. Сокращенно структуру
сплава /// обозначим
![]() ;
структура сплава // —
;
структура сплава // —![]() ;
структура сплаваVI
—
;
структура сплава / — а.
;
структура сплаваVI
—
;
структура сплава / — а.
Сплав V. Так как принципиально значительной разницы в характере превращений сплава V по сравнению со сплавом /// нет, то предлагается этот разбор провести самостоятельно, ориентируясь на нижеприводимые вопросы.
№ 79. 1) Какая фаза выделяется при понижении температуры сплава V от 15 до 25; 2) как изменяется состав твердой и жидкой фаз при понижении температуры от 15 до 25; 3) каков состав жидкой фазы и ее количество при температуре 25; 4) во что кристаллизуется жидкая фаза при температуре 25; 5) изменяется ли состав -кристаллов при охлаждении от температуры 25 до комнатной; 6) какая структура будет у этого сплава после его полного охлаждения? Ответы на эти вопросы см. на с. 64.
Проанализировав
процессы фазовых превращений у сплава
V,
мы
установили, что структура ее после
охлаждения имеет вид
![]() .
В зависимости от состава сплавов, имеют
место различные структуры, а именно: у
сплавов с концентрацией в пределах
.
В зависимости от состава сплавов, имеют
место различные структуры, а именно: у
сплавов с концентрацией в пределах
от Л до К структура состоит из -кристаллов;
от К до Q — из
 -кристаллов;
-кристаллов;от Q до E' — из
 -кристаллов;
-кристаллов;у сплава состава Е' — из эвтектики
 ;
;у сплавов состава от Е' до N — из
 ;
;у сплавов состава от N до В — из -кристаллов.
Структурное состояние сплавов имеет очень большое влияние на свойства сплавов.
Чтобы действительно понять этот материал необходимо, перерисовав диаграмму на лист бумаги, провести повторный разбор ее с построением кривых охлаждения и схем фазовых состояний совершенно самостоятельно. Вы увидите, что самостоятельный разбор не пойдет так гладко, как ожидалось, хотя при разборе ее по учебнику все было ясно. Прежде, чем идти за подсказкой в учебник, попытайтесь сами добраться до истины, но не путем припоминания, что было написано в учебнике. Только методом логического мышления обсудите все варианты решений, которые придут Вам в голову, а не отбрасывайте их, не обдумав.
Диаграмма состояния для сплавов с перитектическим превращением.
Диаграмма состояния с перитектическим превращением представлена на рис. 64. Подобная диаграмма образуется, когда коэффициенты распределения К1>1; К2-<1 и когда жидкая фаза взаимодействуют с ранее образовавшимися кристаллами, образуя новую твердую фазу.
C DE
—
линия ликвидус, CGFE
—
линия солидус сплавов. Сплавы
по концентрации левее точек D'
и
правее Н
кристаллизуется
аналогично сплавам / и VI
(рис.
63) и все, что касалось кристаллизации,
можно перенести на эти сплавы. Сплавы
по концентрации,
расположенные между точками D'
и
F'
претерпевают
особое превращение, с которым надлежит
познакомиться
подробней.
DE
—
линия ликвидус, CGFE
—
линия солидус сплавов. Сплавы
по концентрации левее точек D'
и
правее Н
кристаллизуется
аналогично сплавам / и VI
(рис.
63) и все, что касалось кристаллизации,
можно перенести на эти сплавы. Сплавы
по концентрации,
расположенные между точками D'
и
F'
претерпевают
особое превращение, с которым надлежит
познакомиться
подробней.
Рассмотрим
кристаллизацию сплава /, состав которого
соответствует G'.
Кристаллизация
сплава начинается в точке l1
выделением
твердой фазы переменного состава, как
это легко можно установить, пользуясь
правилом определения концентрации фаз.
Выделяющаяся фаза представляет собой
твердый раствор компонента А
в
В, который
назовем .
По
мере кристаллизации -фаза
меняет свой состав по проекции линии
EF
и
при температуре t2
в
точке G
имеет
состав точки F'.
Жидкая
фаза при этой же температуре имеет
состав D'.
Количество
жидкой и твердой фазы при этой температуре
![]() .
.
При
понижении температуры ниже точки 21
сплав
/ оказывается в однофазной области
-кристаллов,
которые у этого сплава могли образоваться
лишь в результате взаимодействия
существующих ж
и
-фаз.
Коротко сущность механизма образования
-фазы
у сплава / можно представить схемой
![]() .
Это превращение перитектического типа.
.
Это превращение перитектического типа.
Перитектическим называется превращение, когда две фазы определенного состава (жидкая и твердая) взаимодействуя при постоянной температуре, образуют одну новую фазу. В сплавах // и ///, пересекающих линию DGF перитектического превращения, это превращение также имеет место. Если Вы четко усвоили правило отрезков для определения состава и количества фаз, то, пользуясь этим правилом, разобраться в сущности процессов, происходящих при температуре линии DF в сплавах // и ///, не представляет труда. Нужно при этом быть предельно внимательным.
№ 80.
Определите: а) чему равно количество
жидкой ж-
и -
фаз
у
сплава //, если при охлаждении температура
только достигает
22
(рис.
64, а
и
б)?;
б) какая схема превращения сплава // при
22?;
в) из каких фаз состоит сплав // при 22
после
превращения
(точка
2'2
на
кривой охлаждения сплава)?; г) что
происходит со сплавом // при дальнейшем
охлаждении? Ответ (см на с. 64): 1а -
![]() ,
,![]() ;
1б -
;
1б -![]() (остаток);
1в
-
(остаток);
1в
-
![]() ;1г
- в интервале 22—32
жа,
в
точке 32
кристаллизация
закончится,
после чего идет охлаждение твердого
раствора
а;
2а - жD=D,
F
= F;
2б
- ж+a;
2в
- aD;
2г - ниже точки 22
охлаждается
сплав в a-состоянии;
3а -
;1г
- в интервале 22—32
жа,
в
точке 32
кристаллизация
закончится,
после чего идет охлаждение твердого
раствора
а;
2а - жD=D,
F
= F;
2б
- ж+a;
2в
- aD;
2г - ниже точки 22
охлаждается
сплав в a-состоянии;
3а -
![]() и
и![]() 3б -
3б -![]() ;
3в
-
;
3в
-
![]() 3г
- ж
до
точки 32,
после
чего охлаждается сплав в -состоянии.
3г
- ж
до
точки 32,
после
чего охлаждается сплав в -состоянии.
 Легко
видеть, что у сплава // при температуре
перитектического превращения в избытке
жидкая фаза, у сплава III
—
-фаза.
Поэтому превращение их при линии DGF
следующее:
сплав //
Легко
видеть, что у сплава // при температуре
перитектического превращения в избытке
жидкая фаза, у сплава III
—
-фаза.
Поэтому превращение их при линии DGF
следующее:
сплав //
![]() (остаток); сплав ///
(остаток); сплав ///![]() (остаток).
Образующаяся у сплава /// структура
состоит из механической смеси кристаллов
и
а.
(остаток).
Образующаяся у сплава /// структура
состоит из механической смеси кристаллов
и
а.
На рис. 65А-а схематично показан -кристалл и его окружение в сплаве /// в момент достижения перитектической температуры (точка 23). На рис. 65А-б окружение -фазы после реализации перитектического превращения (в точке 2'3 на кривой охлаждения сплава ///, рис. 64б).
На
рис. 65Б
показана
реальная перитектическая структура
сплава системы Sb—Fe.
Темная сердцевина кристаллов
твердого
раствора Sb
в Fe
образовалась при кристаллизации
жидкости; серая оболочка - в результате
перитектического превращения типа
![]() FeSb2
(самая светлая структурная составляющая
- результат дополнительных превращений
при последующем охлаждении сплавов
этой системы; она с перитектическим
превращением не связана).
FeSb2
(самая светлая структурная составляющая
- результат дополнительных превращений
при последующем охлаждении сплавов
этой системы; она с перитектическим
превращением не связана).
С плав
//.
Рис. 64 после 22
продолжает
кристаллизоваться до температуры точки
32.
При
этом жидкость превращается в a-кристаллы.
Окончательная структура этого сплава
состоит из a-кристаллов.
плав
//.
Рис. 64 после 22
продолжает
кристаллизоваться до температуры точки
32.
При
этом жидкость превращается в a-кристаллы.
Окончательная структура этого сплава
состоит из a-кристаллов.
Диаграммы состояния для сплавов, образующих смеси из чистых компонентов.
На рис. 63 представлена диаграмма сплавов, где компоненты ограниченно растворяются друг в друге в твердом состоянии. Линии CFK и DHN диаграммы показывают соответственно значения предельной растворимости компонента В в А и А в В, в зависимости от температуры. Видно, что чем меньше растворимость компонентов в твердом состоянии, тем ближе будут эти линии к осям ординат. Если реальная растворимость очень мала, например, 0,001%, то линии CFK и DHK практически сольются с осями, и диаграмма примет вид, представленный на рис. 66.
Диаграмма состояния Рb—Sb (рис. 66) относится к случаю ограниченной растворимости компонентов сплава в твердом виде. В твердом состоянии они практически не растворимы друг в друге, при кристаллизации образуется механическая смесь компонентов Рb и Sb.
Проведем разбор диаграммы состояния Рb—Sb, используя накопленный опыт. Чтобы установить, какие фазы кристаллизуются из жидкости, рассмотрим сплав / при температуре точки а (рис. 66). Для этого проведем коноду bас через точку а. Видим, что жидкая фаза в точке а имеет состав b'. Состав твердой фазы определяется, очевидно, проекцией точки с коноды bас на концентрационную ось. Эта проекция соответствует чистому компоненту Sb. Кристаллизация любого сплава, имеющего 100% >Sb> 13%, начинается выделением кристаллов Sb. Рассуждая аналогично, приходим к выводу, что у сплавов, имеющих Sb<13%, вначале кристаллизуется Рb.
При температуре 246°С у всех сплавов происходит эвтектическое превращение. Сплавы с концентрацией менее 13% Sb называются доэвтекгическими; их структура Pb+э(Pb+Sb). Сплав состава 13% Sb+87% Pb называется эвтектическим и имеет структуру 9(Pb+Sb). Сплавы с концентрацией правее точки 13% Sb называются заэвтектическими и имеют структуру Sb+э (Pb+Sb). На рис. 67 представлены структуры сплавов Pb—Sb, кристаллизующихся в соответствии с диаграммой Рb—Sb (рис. 66).
№ 81. Сколько и какие фазы присутствуют в области ниже 246°С (рис. 66)? Ответ (см. на с. 65): 1) две фазы Рb и Sb; 2) три фазы Рb +э(Pb+Sb) и Sb.
№ 82.
Каковы составы и относительное количество
эвтектики в структуре сплава 6% Sb
и 94% РЬ (рис. 66)? Ответ (см. на с. 65): эвтектика
сплава 6% Sb+94%
Pb
1) имеет состав 6% Sb+94%
Pb,
количество её 13%; 2) имеет состав 13% Sb+87%
Pb,
количество ее
![]() от общего количества сплава; 3) решить
эту задачу па данном уровне изученного
нами материала невозможно.
от общего количества сплава; 3) решить
эту задачу па данном уровне изученного
нами материала невозможно.
Замечание. При решении этой простой задачи, можно наделать ошибок, если Вы будете пытаться трансформировать правила для определения состава и количества фаз на определение состава и количества эвтектики. Эвтектика не является фазой, она состоит из смеси фаз Pb+Sb. Поэтому прямо применить данное правило для решения задачи нельзя. Задача решается с использованием именно этих правил, но с учётом из какой фазы и при какой температуре образуется эвтектика.
№ 83.
Каковы состав и количество эвтектики
в сплаве состава 56%Sb+44%Pb?
Ответ (см. на с. 66): эвтектика 1) состава
56% Sb
и 44% Рb
в количестве - 50%; 2) состава 13% Sb+87%
Pb,
в количестве - 50%.
83.
Каковы состав и количество эвтектики
в сплаве состава 56%Sb+44%Pb?
Ответ (см. на с. 66): эвтектика 1) состава
56% Sb
и 44% Рb
в количестве - 50%; 2) состава 13% Sb+87%
Pb,
в количестве - 50%.
Диаграммы состояния для сплавов, когда компоненты образуют химические соединения
Н а
рис. 68 представлена диаграмма состояния,
когда компоненты сплава образуют стойкое
химическое соединениеАтВп
и
нестойкое химическое соединение AkBl.
Если
в системе образуется стойкое химическое
соединение, его можно рассматривать
как самостоятельный компонент и диаграмма
разбивается на две: одна - с компонентами
а
рис. 68 представлена диаграмма состояния,
когда компоненты сплава образуют стойкое
химическое соединениеАтВп
и
нестойкое химическое соединение AkBl.
Если
в системе образуется стойкое химическое
соединение, его можно рассматривать
как самостоятельный компонент и диаграмма
разбивается на две: одна - с компонентами
![]() и другая - с компонентамиАтВп
и
В.
Система
А—АтВn
очень
похожа на только что разобранную
диаграмму, где компоненты Рb
и Sb
не растворялись друг в друге в твердом
состоянии.
и другая - с компонентамиАтВп
и
В.
Система
А—АтВn
очень
похожа на только что разобранную
диаграмму, где компоненты Рb
и Sb
не растворялись друг в друге в твердом
состоянии.
№ 84. Какова структура и из каких фаз состоит сплав /, рис. 68? Ответ (см. на с. 66): 1) структура сплава / А+АтВп, фазы те же; 2) структура АтВп+э(АтВп+А), фазы АтВп и A; 3) структура А+э(АтВп+А), фазы А и АтВп.
В правой части «второй» диаграммы с «компонентами» АтВп и В имеется нестойкое химическое соединение состава AkBl, которое разлагается при температуре линии KN при нагреве на фазы ж и В. При охлаждении сплавов, пересекающих линию KN при этой температуре образуется химическое соединение по реакции ж+BAkBl.Это превращение похоже на перитектическое превращение.
Схема процесса кристаллизации сплава // дана на рис. 68б, где приведена схема кривой охлаждения, отмечены фазы при разных температурах и схемы структурных составляющих сплава после полного охлаждения. Для диаграмм состояний со стойкими химическими соединениями характерно наличие максимумов на линии ликвидус. При этом проекции точек максимумов на концентрационную ось соответствуют составам химических соединений. На базе химических соединений могут образовываться твердые растворы, что приводит к появлению новых линий и усложнению диаграммы состояния.
Диаграммы состояния для сплавов, испытывающих полиморфные превращения
При полиморфных превращениях в сплавах происходит перекристаллизация твердых фаз, которая подчиняется тем же законам, как и кристаллизация из жидкого состояния. Если в системе один или оба компонента обладают полиморфными превращениями в твердом состоянии, то и сплавы из этих компонентов претерпевают полиморфные превращения. Диаграммы состояния в этих случаях становятся «многоэтажными». Превращения, соответствующие верхним линиям диаграммы, характеризуют кристаллизацию жидкой фазы, в то время, как линии нижних частей диаграммы характеризуют процессы перекристаллизации в твердом состоянии.
При перекристаллизации в твердом состоянии могут образоваться те же основные фазы, с которыми Вы познакомились ранее.
Вид диаграммы состояния зависит от того, какие фазы образуются в процессе полиморфных превращений в сплавах. Всевозможных комбинаций здесь может быть очень много. Однако при разборе любой диаграммы в силе остаются правила для определения состава и количества фаз и общий принцип разбора диаграмм, который был подробно рассмотрен на примерах простых диаграмм состояний. Если Вы разобрались в этом, то разбор диаграмм состояний любой сложности не представляет трудности.
Н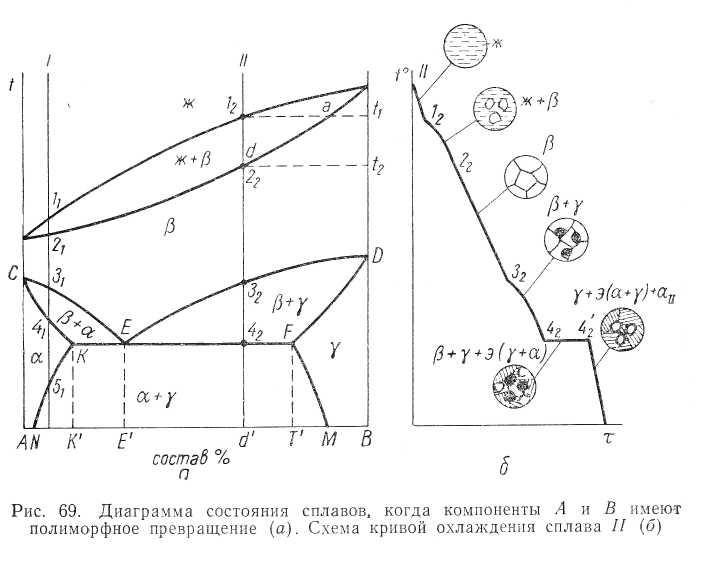 а
рис. 69 представлена диаграмма состояния,
когда компонентыА
и
В
имеют
полиморфные превращения при температурах
С
и
D.
В
высокотемпературных модификациях
компоненты А
и
В неограниченно
растворяются друг в друге и образуют
твердый раствор b.
Растворимость
компонента В
в
А
и
А в В в низкотемпературных модификациях
ограниченная. Отметим, что диаграмма
состоит из двух простых диаграмм,
представленных на рис. 60 и 63.
а
рис. 69 представлена диаграмма состояния,
когда компонентыА
и
В
имеют
полиморфные превращения при температурах
С
и
D.
В
высокотемпературных модификациях
компоненты А
и
В неограниченно
растворяются друг в друге и образуют
твердый раствор b.
Растворимость
компонента В
в
А
и
А в В в низкотемпературных модификациях
ограниченная. Отметим, что диаграмма
состоит из двух простых диаграмм,
представленных на рис. 60 и 63.
Разберем
процесс охлаждения сплава /
(рис. 69). При температуре 11
из
жидкости кристаллизуется b-твердый
раствор. В точке 21
кристаллизация
закапчивается. От точки 21
до
31
идет
охлаждение b-твердого
раствора. В точке -31
начинается перекристаллизация b-фазы
с образованием a-твердого
раствора. При этом состав a-кристаллов
изменяется по линии СК,
b
-
по линии СЕ.
При
температуре 41
перекристаллизация
![]() ,
закончилась,
и в интервале температур 41—51
охлаждается
сплав в a-состоянии.
Так как растворимость компонента В
в
a-твердом
растворе уменьшается по линии KN,
то,
начиная от температуры 51
из
a-фазы
будет выделяться избыточное количество
компонента В
в
виде вторичных кристаллов II-твердого
раствора, и окончательная структура
сплава / будет
,
закончилась,
и в интервале температур 41—51
охлаждается
сплав в a-состоянии.
Так как растворимость компонента В
в
a-твердом
растворе уменьшается по линии KN,
то,
начиная от температуры 51
из
a-фазы
будет выделяться избыточное количество
компонента В
в
виде вторичных кристаллов II-твердого
раствора, и окончательная структура
сплава / будет
![]()
![]() .
.
Разбор
процессов фазовых превращений и
структурообразования сплава //.
(Рекомендуется
параллельно с чтением текста нарисовать
кривую охлаждения сплава.)
Сплав //, охлаждаясь до точки 32,
претерпевает
те же превращения, что и сплав / в интервале
температур 11—31.
Начиная
от точки 32,
происходит
перекристаллизация
![]() .
Состав
b-
и
-фаз
при
этом изменяется по линиям DE
и
DF,
соответственно.
При температуре точки 42
b-фаза
состава Е'
в
количестве
.
Состав
b-
и
-фаз
при
этом изменяется по линиям DE
и
DF,
соответственно.
При температуре точки 42
b-фаза
состава Е'
в
количестве
![]() претерпевает превращение
претерпевает превращение![]() .
Превращение
похоже на эвтектическое с тем отличием,
что превращающаяся фаза является не
жидкостью, а твердым раствором.
.
Превращение
похоже на эвтектическое с тем отличием,
что превращающаяся фаза является не
жидкостью, а твердым раствором.
Превращение, когда твердый раствор определенного состава (E') при постоянной температуре превращается в смесь новых твердых фаз, называется эвтектоидным превращением. Образующаяся при этом механическая смесь кристаллов называется эвтектоидной смесью.
Сплавы, претерпевающие эвтектоидное превращение и имеющие концентрацию левее эвтектоидной (точки Е') условно называются доэвтектоидными. Если концентрация сплава правее эвтектоидной, то говорят о заэвтектоидных сплавах. При эвтектоидном превращении, как и при образовании эвтектики, происходит одновременно перекристаллизация значительного количества ранее существовавшей фазы. Поэтому на кривой охлаждения появляется площадка, величина которой определяется количеством превращающейся фазы.
№ 85.
Из чего будет состоять структура сплава
//, рис. 69, после полного охлаждения? Ответ
(см. на с. 66): 1)
![]() ;
2)у+э(а+у)+аII
;
3) у+э(а+у).
;
2)у+э(а+у)+аII
;
3) у+э(а+у).
№ 86.
Предлагаем самим разобрать сложную
диаграмму (рис. 70), сравнив результаты
с ответом (с. 66).
86.
Предлагаем самим разобрать сложную
диаграмму (рис. 70), сравнив результаты
с ответом (с. 66).
Замечания.
При разборе надлежит:
установить характер фаз в различных областях диаграммы, состояния;
установить природу нонвариантных превращений (С = 0) на линиях EF, KN, GH, МО;
для сплава / нарисовать кривую охлаждения и определить, какая у него будет структура после охлаждения.
Для ориентировки однофазные области (рис. 70) отмечены. Это нужно учесть.
Если что-либо осталось неясным, обязательно проконсультируйтесь с преподавателем.
Неравновесная кристаллизация и перекристаллизация сплавов.
Выше были рассмотрены процессы равновесной кристаллизации, когда диффузионные процессы полностью успевали выравнивать составы фаз.
№ 87. Каков был бы состав кристалла сплава // (рис. 69), если бы его кристаллизация происходила в интервале температур t1 ÷ t2 при отсутствии диффузионных процессов? Ответ (см. на с. 66): состав кристалла 1) был бы равен точке d'; 2) изменялся бы в пределах а—d; 3) внутри соответствует точке а, на периферии — точке d, в промежуточных зонах — между точками а и d.
В реальных условиях диффузионные процессы не успевают полностью выравнивать состав кристаллов. Это явление называется внутрикристаллической или дендритной ликвацией.
Вспомнив условия кристаллизации слитка, нетрудно видеть, что и по зонам состав слитка, если он отлит из сплава, будет неодинаков. Очевидно, корковая зона будет обогащена тугоплавким компонентом, а центральная зона — компонентом с более низкой температурой плавления. В этом случае имеем дело с зональной ликвацией.
В конструкционных сплавах, чаще всего, ликвация — явление нежелательное. Эффект внутрикристаллической ликвации может быть существенно уменьшен последующим нагревом (отжигом), при котором диффузионные процессы, выравнивают состав кристаллитов. Зональная ликвация не устраняется при отжиге.
Эффект ликвации тем больше, чем больше температурный интервал кристаллизации сплава и расстояние по горизонтали между линиями ликвидус и солидус.
№ 88. На рис. 194 и 195 (глава XVIII) приведены диаграммы состояния Сu—Zn и Сu—Sn. Для какого из сплавов: 95%Cu+5%Zn или 95%Сu+5%Sn эффект ликвации должен быть выражен сильнее? Ответ (см. на с. 67): для сплава 1) Сu—Sn; 2) Сu—Zn.
В реальных условиях никогда не реализуется равновесная кристаллизация. Отличными от равновесных составов в процессе протекания кристаллизации будут составы как твердой, так и жидкой фазы. Степень неравновесности жидкой фазы, ввиду более интенсивно протекающих в ней диффузионных процессов, будет меньше, чем в твердой фазе. Поэтому для упрощения разбора будем условно считать, что диффузия не успевает полностью выравнивать состав только кристаллической фазы.
Чтобы понять, к чему это может привести, рассмотрим схему процесса неравновесного роста кристаллита сплава // состава d' (рис. 71), зародыш которого образовался при t1. Очевидно состав с1 этого зародыша будет а. При t2 средний состав c2cp выросшего к этому времени кристаллита (схема б, рис. 71) вместо равновесного b будет промежуточный между а и b, т.е. k, причем (b < k < а); при t3 кристаллит приобретает форму и размеры в соответствии со схемой t3, а средний состав сЗcp его будет l (k>l > h) и т.д. Важно, что завершение роста кристаллита произойдет не при t4 (температура равновесного солидуса), когда средний состав кристаллита соответствует т. При t5<t4 состав с5ср=п=d равен составу исходного сплава. Это состояние будет достигнуто только к t4. При t4 периферийная оболочка кристаллита (схема t4 на рис. 71), должна иметь состав с = е. Рост кристаллита сопровождается изменением состава внутренних слоев кристаллита в сторону выравнивания (схема t5 рис. 71б). Линию aklmn, соответствующую фактическим точкам конца кристаллизации для сплавов разного состава в реальных (неравновесных) условиях, называют неравновесным ликвадионным солидусом системы.
№ 89. Как распределяется концентрация тугоплавкого и легкоплавкого компонентов в пределах кристаллитов и в межкристаллитных зонах? Ответ (см. на с. 67): внутренние зоны кристаллита (оси дендритов) обогащены 1) легкоплавким, периферийные и межкристаллитные зоны - тугоплавким; 2) тугоплавким, периферийные и межкристаллитные зоны - легкоплавким компонентами.
Учесть количественно эффект ликвации трудно, т.к. ликвационный солидус ак1тп (рис. 71) изменяется при изменении условий кристаллизации (скорости охлаждения).
Охлаждение
сплава // (рис. 71) ниже t5
сопровождается
некоторым выравниванием состава в
пределах дендритов. Но мало вероятно,
что к t6
состав
в пределах кристаллов окажется равновесным
(равным d'),
т.к.
температура относительно низкая.
Практически
в пределах зерна подвергается
перекристаллизации сплав разного
состава. Это приводит к фазовым
превращениям
![]() при
температурах ниже t6...t7
на
линиях диаграммы ED
и
DF.
Для
превращения
при
температурах ниже t6...t7
на
линиях диаграммы ED
и
DF.
Для
превращения
![]() необходимо,
чтобы состав в превращающемся объеме
соответствовал значению d,
что будет достигнуто, когда температура
сплава окажется ниже равновесной (t6)
из-за релаксации
процессов диффузии.
(О сущности явлений и релаксации
посмотрите на с. 464.)
необходимо,
чтобы состав в превращающемся объеме
соответствовал значению d,
что будет достигнуто, когда температура
сплава окажется ниже равновесной (t6)
из-за релаксации
процессов диффузии.
(О сущности явлений и релаксации
посмотрите на с. 464.)
Для упрощения допустим, что перекристаллизация сплава // протекала в интервале t6...t7 в равновесных условиях, и ниже точки р состав кристаллов соответствует d'. Дальнейшее охлаждение сплава проводится форсированно. Тогда в условиях неравновесной перекристаллизации выделение aII-кристаллов из -фазы начнется не при ts в точке r в соответствии с линией Ff, а при более низкой температуре t9, в точке s на линии Ff. При этом состав -фазы соответствует проекции точки s и при дальнейшем охлаждении изменяется по линии sf. При более высокой скорости охлаждения выделение aII начинается при t10, и изменение состава у происходит по линии qf". В пределе (при очень большой скорости охлаждения) можно получить однофазное у-состояние состава d' при нормальной температуре. Естественно, что g-фазы составов f, /", d' являются пересыщенными твердыми растворами и поэтому неустойчивыми состояниями.
№ 90. Чем можно объяснить возможность существования при нормальной температуре g-фазы состава f" или d (рис. 71)? Ответ (см на с. 67): 1) малой развитостью диффузионных процессов при пониженных температурах; 2) более низким значением изобарного потенциала d фазы у состава d' или f", чем g-фазы состава f; 3) кинетическими условиями перекристаллизации.
Для практических целей очень важно учесть, что выделяющиеся из g-фазы aII-кристаллы по величине (rk) зависят от степени переохлаждения п1 = t8-t9 или п2=n2=t8-t10 и т. д., при котором происходит процесс их выделения. Это целиком и полностью объясняется термодинамическими условиями, как и при кристаллизации жидкой фазы (рис. 15).
№ 91.
Выделение aII-кристаллов
происходило при непрерывном охлаждении
в интервале температур t9÷t10
(рис.
71). Каковы по размерам будут кристаллы
aII?
Ответ (см на с. 67): Кристаллы aII
1) одинаковые; 2) различные; 3) образовавшиеся
при t=t9
по
величине крупнее кристаллов, выделившихся
при t<t9,
которые тем мельче, чем ниже температура
их образования.
91.
Выделение aII-кристаллов
происходило при непрерывном охлаждении
в интервале температур t9÷t10
(рис.
71). Каковы по размерам будут кристаллы
aII?
Ответ (см на с. 67): Кристаллы aII
1) одинаковые; 2) различные; 3) образовавшиеся
при t=t9
по
величине крупнее кристаллов, выделившихся
при t<t9,
которые тем мельче, чем ниже температура
их образования.
Чем мельче кристаллы a11, тем больше суммарная поверхность границ a-фазы в g-твердом растворе и тем больше составляющая поверхностной энергии в энергетическом балансе системы, т.е. тем больше термодинамический потенциал G, и менее устойчива система.
Поэтому наряду с выделением aII-кристаллов из g-фазы происходит также растворение мелких частиц aII в g-фазе. Избыток атомов А в g-фазе диффундирует к более крупным частицам aII, оседает на них, приводя к их дальнейшему укрупнению. Это явление называется коагуляцией. Эффективность коагуляции возрастает с уменьшением скорости охлаждения и может быть увеличена повторным нагревом сплава. Это явление имеет очень важное практическое значение, его понимание позволяет объяснить многие особенности свойств реальных сплавов (в частности отпускную хрупкость стали).
Учет влияния поверхностной энергии на изобарный потенциал G сплавов позволяет объяснить и такое явление, как сфероидизацию - процесс перехода пластинчатых или игольчатых структурных составляющих сплава в сфероидальную форму. На рис. 82г и 82д показаны микроструктуры стали эвтектоидного состава, которые имеют либо пластинчатую (г) либо сфероидальную (д) форму эвтектоидной структуры.
№ 92. Чем объяснить процесс сфероидизации? Ответ (см на с. 67): при сфероидизации 1) возрастает термодинамическая устойчивость сплава; 2) уменьшающаяся поверхностная энергия снижает значение изобарного потенциала; 3) возрастает изобарный потенциал системы.
Важно понять, что сфероидизация и коагуляция - это структурообразующие процессы. Образование новой структуры идёт через растворение менее устойчивых частиц выделившейся фазы в маточном растворе и диффузионный перенос растворенных атомов к другим частицам этой же фазы, но другой формы или размеров. Вследствие чего уменьшается изобарный потенциал G системы. Данное положение используется на практике для изменения свойств сплава путем направленного влияния на размер и форму структурных составляющих.
В условиях неравновесной перекристаллизации возможно также образование квазиэвтектоидных структур. В сплавах, близких по составу к эвтектоидному (например сплав /, рис. 71) при быстром охлаждении может быть подавлено выделение a-кристаллов из b-фазы, начиная от точки 3. Тогда b-фзза превращается сразу в смесь кристаллов a+g, и у сплава / образуется так называемая квазиэвтектоидная структура, состав которой равен составу сплава / и не соответствует точке Е'. Это имеет место, когда превращение b-фазы начнется при переохлаждениях, соответствующих температуре точки 5 или ниже. Минимальные степени переохлаждения, вызывающие образование квазиэвтектоидных структур зависят от состава сплавов и находятся на пунктирных продолжениях линий СЕ и DE, т.е. на линиях Ее или Ed (рис. 71а), в зависимости от состава сплава.
Как следует из рассмотрения реальных условий кристаллизации и перекристаллизации, строение сплавов может сильно отличаться от равновесного. Это не значит, что практическая значимость диаграмм состояния становится сомнительной. Наоборот, при творческом использовании теоретических закономерностей фазовых превращений по диаграммам состояния и законов, определяющих реальную кинетику этих превращений, обеспечиваются условия создания и обработки сплавов для получения материалов с требуемыми свойствами.
Связь между диаграммами состояния и возможностью термической обработки сплавов
Термической обработкой называют совокупность операций нагрева и охлаждения сплавов в определенном режиме с целью получения требуемых структур и свойств сплавов. Режим обработки задаётся на практике технологическим регламентом.
Наличие фазовых превращений в твердом состоянии широко используется для изменения структуры и свойств сплавов методом термической обработки. Например, нагревом сплава / (рис. 69а) выше точки 52 получаем состояние сплава, соответствующее a-твердому раствору. При быстром охлаждении этого сплава можно затормозить выделение gII-кристаллов и зафиксировать при нормальной температуре пересыщенный твердый раствор а, который уже будет иметь свойства, отличные от свойств сплава в равновесном состоянии.
Нагревом сплавов I, // (рис. 69) выше точек З1, 32 до области b-фазы и последующим быстрым охлаждением можно затормозить полностью или частично фазовые превращения, которые должны протекать в соответствии с диаграммой состояния при охлаждении. Операция термической обработки - быстрое охлаждение от температур нагрева выше температуры фазовых превращений в твердом состоянии, в результате которой при низких температурах фиксируется неравновесное состояние сплава, называется закалкой.
Нагрев закаленного сплава ниже температур фазовых превращений называется отпуском. Отпуск содействует развитию диффузионных процессов и уменьшению степени неравновесности сплава. Разновидностью отпуска является также старение. При старении в закаленных сплавах протекают процессы, приближающие сплав к более устойчивому состоянию. Различают естественное старение, протекающее при нормальной температуре, и искусственное старение, происходящее при повышенных температурах.
Процессы старения обычно сопровождаются повышением прочности и уменьшением пластичности и вязкости сплава. Старение сплавов после закалки называют также дисперсионным старением. Таким образом, можно различить отпуск упрочняющий (называемый в технологической литературе – старение), и смягчающий (называемый – отпуск, соответственно).
Чтобы получить состав сплава близкий к равновесному состоянию, необходимо нагреть сплав до температуры выше температуры фазовых превращений в твердом состоянии и очень медленно охладить; такая термическая обработка называется фазовым отжигом. При отжиге все фазовые превращения должны успеть в максимальной степени совершиться.
Вышеприведенные операции имеют место, если в сплаве происходят фазовые превращения в твердом состоянии.
№ 93. Можно ли провести закалку и фазовый отжиг сплавов // и VI, кристаллизующихся по диаграмме состояния рис. 63? Ответ (см на с. 67): 1) можно; 2) нельзя; 3) для сплава VI нельзя, для сплава // можно.
Итак, диаграммы состояния являются незаменимым пособием, на основании которого устанавливается возможность или невозможность осуществления того или иного вида термообработки, а также температурные режимы термообработки.
Связь между свойствами сплавов и типом диаграммы состояния. Физико-химический закон Н.С. Курнакова
Физические свойства сплавов зависят от фазового состояния сплавов. Исследованиями Н.С. Курнакова, А.А. Бочвара установлена связь между диаграммами состояния сплавов, физическими и технологическими свойствами сплавов.
На рис. 72 (А) приведены четыре основных типа диаграмм состояния и закономерности изменения свойств у этих сплавов в зависимости от состава, которые заключаются в следующем.
Если при сплавлении компонентов образуется механическая смесь фаз, то свойства сплавов с изменением состава изменяются по закону прямой линии (аддитивно), рис. 72 (A, а).
Если компоненты при сплавлении образуют неограниченные твердые растворы, то свойства изменяются по криволинейному закону с максимумом или минимумом, рис. 72 (A, б).
Если при сплавлении компонентов образуются ограниченные твердые растворы, то в той части, где имеют место однофазные области твердых растворов, свойства изменяются по закону кривой линии. В двухфазных областях свойства изменяются аддитивно, рис. 72 (А, в).
Если компоненты образуют химическое соединение, то составу химического соединения соответствует максимум или минимум на кривой изменения свойств. Эта точка перелома, соответствующая составу химического соединения, называется сингулярной точкой, рис. 72 (А, г).
П редставленная
на рис. 72 (А)
связь
между свойствами и видом диаграммы
состояния сплавов является приближенной
схемой. Здесь не учитывается влияние
свойств структуры (формы и размеров
кристаллов) и температурного фактора.
редставленная
на рис. 72 (А)
связь
между свойствами и видом диаграммы
состояния сплавов является приближенной
схемой. Здесь не учитывается влияние
свойств структуры (формы и размеров
кристаллов) и температурного фактора.
Так, в частности, при образовании механической смеси фаз дисперсные фазы (эвтектические и эвтектоидные структуры) могут достаточно резко отличаться по твердости и прочности от грубокристаллических структур, что приводит к нарушению закона аддитивности. Наличие в структурах отдельных сплавов различного количества составляющих с низкой температурой плавления также может изменить свойства сплава.
Знание изучаемых закономерностей значительно облегчает создание новых сплавов с заданными свойствами и содействует более целенаправленному использованию существующих сплавов.
№ 94. Требуется подобрать сплав для изготовления реостатной проволоки с высоким электросопротивлением. Сплавы, какого типа диаграммы состояния, наиболее вероятно подошли бы для этой цели (рис. 72A)? Ответ (см. на с. 67): сплавы типа 1) а; 2) б; 3) г.
Основные положения при выборе сплавов для конкретного назначения. Наиболее часто технические сплавы являются двух или многофазными, состоящими из твердых растворов и включений других фаз, преимущественно в виде химических соединений, которые тормозят движение дислокаций и повышают предел текучести материала.
На рис. 73а показано движение дислокации в таких материалах при их нагружении.
1. Когда
расстояние l
между включениями М
достаточно
велико, движущаяся дислокация начинает
огибать включения (рис. 73а
1,2).
При
этом увеличивается длина дислокации,
и возникают силы, стремящиеся восстановить
прямолинейную форму дислокации (с. 526
Приложения). Проталкивание дислокации
между включениями, расстоян ие
между которымиl,
вызывает
напряжение
ие
между которымиl,
вызывает
напряжение
![]() ,
гдеG
-
модуль сдвига, b
-
вектор Бюргерса дислокации. При
действующем напряжении
,
гдеG
-
модуль сдвига, b
-
вектор Бюргерса дислокации. При
действующем напряжении
![]() дислокация
выгибается между частицами (3,
4);
её
участки за ними смыкаются, образуя
дислокационные петли 5.
При движении новых дислокаций образуются
новые кольца, суммарная длина дислокации
и энергия решетки растет, что дополнительно
затрудняет проталкивание новых
дислокаций.
дислокация
выгибается между частицами (3,
4);
её
участки за ними смыкаются, образуя
дислокационные петли 5.
При движении новых дислокаций образуются
новые кольца, суммарная длина дислокации
и энергия решетки растет, что дополнительно
затрудняет проталкивание новых
дислокаций.
2. Если расстояние l между частицами очень мало, возможно перерезание дислокацией частиц включений. Из-за этого внутри частицы возникает сдвиг на величину вектора Бюргерса дислокации, что приводит к увеличению поверхности между матрицей и перерезанной частицей, благодаря чему дополнительно возрастает сопротивление движению дислокации.
№ 95. Выберите, какие из материалов, приводимых в ответах, являются наиболее прочными? Ответ (см. на с. 68): 1) твердые растворы; 2) чистые химические соединения; 3) твердые растворы с мелкодисперсными включениями химических соединений.
Ниже приводятся основные положения, которыми следует руководствоваться при создании или выборе сплавов для того или иного назначения.
1. Наилучшими конструкционными материалами, от которых требуется высокая прочность при достаточной пластичности, являются твердые растворы с дисперсными включениями другой фазы. Следует по возможности избегать двухфазных сплавов, когда другая фаза выделяется вокруг зерен основной фазы сплава. Такие сплавы отличаются высокой хрупкостью. Очень высокопрочными являются сплавы, упрочненные нитевидными монокристаллами направленно растущих эвтектик (композиты).
Наилучшими материалами для очень износостойких инструментов являются сплавы, основу которых составляют высокотвердые химические соединения, сцементированные вязкой фазой твердого раствора.
В качестве подшипниковых материалов наиболее подходящими являются сплавы, состоящие из смеси разных фаз, когда основу сплава составляет мягкая фаза или структурная составляющая, в которую вкраплены более твердые кристаллы.
В качестве легкоплавких сплавов и припоев применяются эвтектические или близкие к ним сплавы.
При выборе сплавов необходимо учитывать и их технологические свойства. А. А. Бочваром установлены зависимости между строением и технологическими свойствами сплавов (рис. 72 Б).
Лучшими для изготовления деталей обработкой давлением являются чистые металлы или однофазные твердые растворы. Обработке резанием лучше поддаются многофазные сплавы. Лучшими литейными свойствами обладают эвтектические или близкие к ним по составу сплавы.
№ 96. Какой из сплавов с диаграммой состояния рис. 63 следует выбрать для изготовления изделий а) глубокой штамповкой, б) литьем? Ответ (см. на с. 68): 1) для штамповки сплавы / или //, для литья сплав IV; 2) для штамповки сплавы / или VI, для литья сплав //; 3) для штамповки сплавы / или VI, для литья сплав IV.
Понятия о диаграммах состояния тройных сплавов
Помимо двойных сплавов в технике часто применяются сплавы более сложного состава, диаграммы состояния которых также несравнимо более сложны, чем диаграммы состояния двойных сплавов.
В этом разделе надлежит познакомиться, главным образом, с принципами разбора диаграмм состояния тройных сплавов.
Диаграммы состояния тройных сплавов являются пространственными фигурами (рис. 74а). Для отражения концентрации тройного сплава обычно используется часть плоскости в виде равностороннего треугольника, который называется концентрационным треугольником (рис. 74г).
В
вершинах треугольника отмечаются
компоненты А,
В, С, образующие
тройную систему. Стороны треугольника
соответствуют двойным сплавам А—В,
В—С,
С—А.
Любая
т очка
внутри треугольника соответствует
вполне определенному по составу тройному
сплаву.
очка
внутри треугольника соответствует
вполне определенному по составу тройному
сплаву.
При определении концентрации тройного сплава за 100% состава сплава принимается длина стороны треугольника. Профессором Ю.А. Геллером предложен очень удобный метод определения концентрации тройного сплава по правилу трех отрезков. Рассмотрим определение концентрации сплава в точке О (рис. 74г) по этому методу. Для этого через точку О проводят два отрезка, например ор и or, параллельные двум сторонам треугольника АС и ВС с выходом этих отрезков на третью сторону АВ. Точки пересечения делят сторону АВ на три части Ар, рr и rВ. При этом длина отрезка рr, противолежащая вершине С, покажет содержание компонента С. Длина отрезка rВ, прилегающего справа, покажет содержание компонента, расположенного в левой вершине (А на рис. 74г). Длина отрезка Ар, прилегающего слева, показывает количество компонента, расположенного в правой вершине В.
№ 97. Чему равен состав тройного сплава Bi—Pb—Sn, (рис. 75А) в точке е? Ответ (см. на с. 68): 1) Bi=30%, Sn=40%, Pb=30%; 2) Sn=70%, Pb=40%, Bi=90%; 3) Bi=40%, Sn=30%, Pb=30%.
На рис. 74а представлена диаграмма состояния тройной системы А—В—С, когда компоненты в твердом состоянии практически взаимонерастворимы.
Диаграмма представляет трехгранную призму, основанием которой является концентрационный треугольник, гранями — диаграммы состояния двойных сплавов А—В, В—С и С—А. Сверху диаграмму ограничивает сложная поверхность, состоящая из трех поверхностей ликвидусов А1l1Ее3А1, В1е1Ее2В1 и С1е2Ее3С1 которые примыкают соответственно к компонентам А, В и С на диаграмме состояния.
Рассмотрим процесс кристаллизации сплава /, состава точки О' внутри концентрационного треугольника ABC (рис. 74а). При охлаждении сплава / до температуры t1 (точка 1 на кривой охлаждения, рис. 74б), охлаждается жидкая фаза. При достижении температуры t, (точка 0) на поверхности ликвидус BielEe2BI из жидкости начинают выделяться кристаллы компонента В. По мере выделения кристаллов В состав жидкой фазы изменяется по проекции кривой Ob, являющейся продолжением отрезка, проведенного через вершину В и точку О' состава сплава. При температуре t2 состав жидкой фазы соответствует проекции точки b пересечения линии
Об с линией е1E, являющейся линией пересечения поверхностей ликвидусов, примыкающих к вершинам B1 и А1. Начиная от температуры t2 из жидкой фазы одновременно кристаллизуются компоненты В и А, т. е. образуется двойная эвтектика э(А+В).
№ 98. Чему равно число степеней свободы С и при каких температурных условиях t кристаллизуется двойная эвтектика в тройном сплаве? Ответ (см. на с. 67): при 1) С=0, t=const; 2) СО, tconst; 3) С=1, при понижении t.
Условие кристаллизации двойной эвтектики соответствует участку 2—3 на кривой охлаждения. При понижении температуры по мере кристаллизации двойной эвтектики э(А+В) состав жидкой фазы изменяется по проекции линии bЕ. При температуре t3 состав жидкой фазы соответствует проекции точки Е, пересечения трех поверхностей ликвидусов, идущих от вершин А1 В1 и С1. При t3 происходит окончательная кристаллизация оставшейся жидкости в тройную эвтектику э(А+В+С) при постоянной температуре, так как С=3-4+1=0. Таким образом, в процессе кристаллизации сплава / образовалась структура, состоящая из кристаллов В+э(А+В)+э(А+В+С), схема которой приведена около кривой охлаждения на участке ниже 3—3' (рис. 74б).
№ 99. Какая структура образуется при кристаллизации сплава // состава к' (рис. 74а)? Ответ (см. на с. 67): структура состоит из 1) А+э(А+В)+э(А+В+С); 2) C+э(А+В+С); 3) А+э(А+В+С).
К отмеченным поверхностям ликвидусов можно добавить дополнительные элементы диаграммы, каковыми являются линии пересечения поверхностей ликвидусов е1Е, е2Е,е3Е, квалифицируемые как линии двойных эвтектик э(А+В), э(В+С), э(А+С), соответственно. Точка Е пересечения трех поверхностей ликвидусов является точкой тройной эвтектики и плоскость, проведенная через нее, является поверхностью солидус системы.
Разбор пространственных диаграмм состояния тройных систем по рассмотренной методике, в виду сложного строения диаграммы, не всегда удается осуществить достаточно наглядно и убедительно. Обычно диаграммы состояния представляются не в виде пространственного изображения (рис. 74а), а в виде проекций линий пересечения поверхностей пространственной диаграммы на плоскость концентрационного треугольника (рис. 74в). Как видно из рис. 74в концентрационный треугольник проекциями линий е1Е, е2Е, е3Е двойных эвтектик разбивается на три области, примыкающие к вершинам А, В и С треугольника.
Рассмотрим процесс кристаллизации и структурообразования по проекции диаграммы на рис. 74в для наиболее общего случая. При разборе процесса кристаллизации любого тройного сплава, заданного точкой внутри треугольника, прежде всего, нужно посмотреть, в какой из отмеченных 3-х областей располагается эта точка. Если эта область примыкает к вершине А, то кристаллизация сплава начинается выделением компонента А и т. д. Состав жидкой фазы по мере выделения кристаллов соответствующего компонента изменяется по продолжению линии, проведенной через точку состава и вершину треугольника, отведенную этому компоненту. Состав кристаллизующейся двойной эвтектики при дальнейшем охлаждении сплава определяется тем, на линию какой двойной эвтектики выходит проведённая прямая. Выделение двойной эвтектики сопровождается изменением состава жидкой фазы по линии двойной эвтектики во внутрь треугольника. При достижении состава тройной эвтектики Е кристаллизация заканчивается образованием тройной эвтектики э(А+В+С). Более просто кристаллизуются сплавы, составы которых находятся на линиях двойных эвтектик или линиях, проходящих через вершины треугольника и точку Е.
№ 100. Состав структуры после кристаллизации сплава, состава точки т, (рис. 74в)? Ответ (см. на с. 68): 1) В+э(А+В)+э(А+В+С); 2) э(В+С)+э(А+В+С); 3) э(А+В+С).
Итак, пользуясь диаграммой (рис. 74в) можно разобраться в характере образующихся структур для сплава любого состава данной системы.
Для
тройных сплавов сохраняется в силе
правило отрезков для определения
количества фаз в сплаве. Для сплава s
(рис. 74в)
при
достижении
составом
жидкой фазы от выделения кристаллов
компонента С
точки
r
количество жидкой фазы равно
![]() ,
а количество кристаллов -
,
а количество кристаллов -![]() .
Этим правилом можно воспользоваться и
при определении количества структурных
составляющих в сплаве после кристаллизации.
.
Этим правилом можно воспользоваться и
при определении количества структурных
составляющих в сплаве после кристаллизации.
Проделаем
это для сплава состава точки с
(рис.
74), структура которого В+э(А+В)+э(А+В+С).
Количество
кристаллов
![]() .
Количество тройной эвтектикиэ(А+B+С)
найдем
из дополнительного построения отрезка,
проходящего через точки E
и
о
до
пересечения со стороной треугольника
в точке р.
Количество
э(А+-В+С)
=
.
Количество тройной эвтектикиэ(А+B+С)
найдем
из дополнительного построения отрезка,
проходящего через точки E
и
о
до
пересечения со стороной треугольника
в точке р.
Количество
э(А+-В+С)
=![]() .
Количество
двойной
эвтектики э(А+В)=
100-[В+э(А+В+С)].
.
Количество
двойной
эвтектики э(А+В)=
100-[В+э(А+В+С)].
Недостатком метода проекции при изучении тройных систем является отсутствие температурной оси. Недостаток в значительной мере устраняется, если на проекцию диаграммы нанесены проекции линий пересечения поверхностей пространственной диаграммы изотермическими плоскостями, т.е. изотермы. На рис. 74а в левой части показаны линии пересечения нескольких изотермических плоскостей с отдельными поверхностями пространственной диаграммы. На рис. 75, представлена диаграмма состояния тройной системы Pb—Sn—Bi с такими изотермами. На рис. 75 (Б) приведены структуры нескольких тройных сплавов системы Pb—Sn—Bi.
Замечание. По составу сплавов установите, где эти сплавы находятся на диаграмме состояния (рис. 75 А) и по диаграмме подтвердите структурное состояние их на рис. 75 (Б). По диаграмме (рис. 75 А) можно с определенной степенью уверенности судить о температурах фазовых превращений при кристаллизации сплава любого состава.
№ 101.
Задача для самостоятельного изучения.
Имеется структура сплава состава
45%Bi+40%Sn+15%Pb
(рис. 75 Б,
а).
Вопрос:
а) из чего состоит структура этого
сплава? б) при каких температурах
образовались структурные составляющие
этого сплава? в) чему равно относительное
количество структурных составляющих
в структуре сплава? г) какой сплав в
данной системе имеет минимальную
температуру плавления?
Решите все эти задачи на бумаге и сравните
Ваши результаты с ответом на с. 68.
Расчеты
количества структурных составляющих
сопоставьте с реальной микроструктурой
сплава на рис. 75 (Б,
а),
по
которой на глаз также определите
количество структурных составляющих.
101.
Задача для самостоятельного изучения.
Имеется структура сплава состава
45%Bi+40%Sn+15%Pb
(рис. 75 Б,
а).
Вопрос:
а) из чего состоит структура этого
сплава? б) при каких температурах
образовались структурные составляющие
этого сплава? в) чему равно относительное
количество структурных составляющих
в структуре сплава? г) какой сплав в
данной системе имеет минимальную
температуру плавления?
Решите все эти задачи на бумаге и сравните
Ваши результаты с ответом на с. 68.
Расчеты
количества структурных составляющих
сопоставьте с реальной микроструктурой
сплава на рис. 75 (Б,
а),
по
которой на глаз также определите
количество структурных составляющих.
В тройных системах могут образоваться химические соединения, твердые растворы; происходить полиморфные превращения и т.д., что в значительной степени усложняет вид диаграммы.
Для решения ряда практических задач широко пользуются изображениями горизонтальных и вертикальных сечений диаграмм состояния тройных сплавов.
Часто строятся сечения диаграмм вертикальными плоскостями, параллельными одной из сторон концентрационного треугольника или проходящими через какую-либо вершину треугольника. Для этого приготавливают ряд сплавов, состав которых находится на соответствующей линии. Для этих сплавов строят кривые охлаждения. По кривым охлаждения устанавливают критические точки сплавов так же, как при построении диаграмм состояния двойных сплавов.
Для примера построим по имеющейся тройной диаграмме состояния (рис. 76а) её вертикальное сечение DF. Для этого выберем сплавы по составу отличающиеся типичными структурами. Такими сплавами являются сплавы состава точек D, 1, 2, 3, 4, 5, 6, 7, F на рис. 76а. Для сокращения: двойные эвтектики обозначены: э(А+В)—l3, э(А + С)—l1 э(В+С)—12 и тройная эвтектика э(А+В+С)—Е. Структуры и последовательность кристаллизации сплавов следующие: D-A+l3, 1—А+l3+Е, 2—А+Е, 3—А+l1+Е, 4—l1+E, 5—C+l1+E, 6—С+Е, 7—C+l2+E, F—C+l2. Начало выделения каждой из этих фаз или структурных составляющих дает соответствующую критическую точку на кривой охлаждения (рис. 76б).
Далее следует взять отрезок, равный по длине DF, отметить на нем составы изучаемых сплавов; восстановить из этих точек перпендикуляры и отметить на них положение критических точек. Полученные системы точек, соответствующие однотипным превращениям в сплавах при кристаллизации, необходимо соединить линиями, в результате чего получим вертикальное сечение тройной системы (рис. 76в), где отмечены также фазы и структурные состояния в разных областях.
В ертикальные
разрезы особенно широко используются
для технических сплавов на железной
основе, типа железо-углерод-легирующий
элемент. Они позволяют установить
изменение температур кристаллизации
и фазовых превращений в твердом состоянии
для серии сплавов, у которых целенаправленно
изменяют содержание одного компонента
(обычно углерода) в составе сплава. Такие
сечения похожи на диаграммы состояния
двойных сплавов и аналогично последним
являются основанием для решения многих
важных вопросов.
ертикальные
разрезы особенно широко используются
для технических сплавов на железной
основе, типа железо-углерод-легирующий
элемент. Они позволяют установить
изменение температур кристаллизации
и фазовых превращений в твердом состоянии
для серии сплавов, у которых целенаправленно
изменяют содержание одного компонента
(обычно углерода) в составе сплава. Такие
сечения похожи на диаграммы состояния
двойных сплавов и аналогично последним
являются основанием для решения многих
важных вопросов.
Пояснения к ответам на вопросы главы VI
№ 63.
1). Неправильно. В этом случае не соблюдается третье обязательное условие, необходимое для образования таких твердых фаз.
2). Правильно. Электронное строение атомов таких элементов близко, значит, близки и свойства.
3). Вы ошибаетесь. Подумайте, для каких элементов в наибольшей степени выполняется третье условие, необходимое для полной растворимости.
№ 64.
1). Правильно. При этом дополнительно необходимо, чтобы Н = Hт.р — Hс.с < Т (Sc.c — ST.P) так как S при упорядочении < 0.
2). Ошибаетесь. В таких условиях упорядочение невозможно, т.к. при образовании сверхструктуры G>0.
3). Это условие нереализуемое, так как ST.P > Sc.c.
№ 65.
1). Правильно. Энергия активации в этом случае относительно мала.
2). Неправильно. Для того, чтобы атом из одного узла перешел в другой узел, нужно предварительно освободить ему место, удалив из узла атом основного металла.
№ 66.
1). Совершенно верно. Кристаллизация сплавов преимущественно протекает в интервале температур, т.к. С=К-Ф+1=2-2+1=1.
2). Ошибаетесь. Система при кристаллизации имеет К=2, Ф=2. Поэтому С=К-Ф+1=1, а не нуль, как при кристаллизации чистого вещества.
3). Ответ неопределенный. Установите, чему равно число степеней свободы при кристаллизации сплава.
№ 67.
1). Это категорическое заявление. Вы исходите из того, что при кристаллизации образуется одна твердая фаза, но это наблюдается не всегда.
2). Правильно. Тогда С=2-3+1=0 и tKp=const, то же, что и при кристаллизации чистого вещества.
3). Неправильно. Возможно ли в сплаве из двух компонентов сосуществование больше трех фаз, например 4? Тогда из условия С=К-Ф+1 получим С=2-4+1<0, что бессмысленно.
№ 68.
1). Правильно. На оси ординат отмечается температура, на оси абсцисс — концентрация компонентов.
2). Ошибаетесь. Прочтите внимательно, что такое диаграмма состояния.
№ 69.
1). Ошибаетесь. При данных условиях кристаллизации диффузионные процессы успеют выравнивать состав фаз.
2). Правильно. В равновесных условиях кристаллизация завершается образованием кристаллов, состав которых соответствует составу сплава, т.к. диффузионные процессы успевают привести состав фаз в полное соответствие с диаграммой состояния.
№ 70.
1). Ошибаетесь. Это состав сплава ///.
2). Правильно. Состав -фазы соответствует проекции точки 2"'.
3). Вы не знаете, как по оси концентрации определяется состав сплава. Обязательно разберитесь.
№ 71.
1). Правильно. p - состав твердой, а q' - состав жидкой фазы.
2). Ошибаетесь относительно количества В в твердой фазе.
3). Неправильно. Это состав сплава.
№ 72.
1). Правильно. Для сплавов //, ///, IV при температурах 2', 2", 2'" длина отрезка коноды, входящего в числитель отношения отрезков, определяющего количество жидкой фазы, равна нулю.
2). Ответ правильный, но неточный.
3). Ошибаетесь. Делать столь категорические выводы нет оснований.
№ 73.
1). Ошибаетесь. Для рис. 60 К1>1, К2<1.
2). Неправильно. В этом случае K2<1 и поэтому линии ликвидус и солидус диаграммы от чистых компонентов идут в сторону понижения и при каком-то составе сплава дают общий минимум.
