
2013-СК-біохімія-02-Осн фіз хім
.pdfЯ. Вант-Гофф (1887) запропонував для обчислення осмотичного тиску застосовувати газові закони:
Осмотичний тиск розчину дорівнює тому тиску, який чинила б розчинена речовина, перебуваючи за тієї ж температури у газоподібному стані і займаючи об'єм, однаковий з об'ємом розчину.
Об'єднане рівняння газового стану Менделєєва – Клайперона:
pV= νRT=(mRT)/M
31
Об'єднане |
рівняння |
газового |
стану |
Менделєєва– |
Клайперона: pV= νRT=(mRT)/M
Рівняння осмотичного тиску розчину Вант-Гоффа
π = (mRT)/(MV) = CMRT,
де π– осмотичний тиск розчину, кПа; CM- молярна
концентрація розчину, моль/л; R- універсальна газова стала {8,314 Дж/(моль К)}; Т – абсолютна температура, К.
Закон Вант-Гоффа:
Осмотичний тиск розчину прямопропорційний його молярній концентрації та абсолютній температурі.
Величина осмотичного тиску розчину залежить від осмотичної концентрації (осмомоляльності)
π= (mRT)/(MV) = CосмRT,
32

Біологічні рідини є водними розчинами багатьох мінеральних і органічних речовин (р=constant)
Плазма крові р = 770 – 821 кПа (7,6 – 8,1 атм)
р крові зумовлюють іони Na+ і Cl- (на 60 %), білки – в меншій мірі.
Тиск, що створюється високомолекулярними біологічно активними сполуками, називають онкотичним тиском.
0,5 % від загального осмотичного тиску (3,04
–4,05 кПа або 0,03 – 0,04 атм);
на 80% визначається альбумінами;
оскільки р лімфи ~ 1,33 кПа, р крові ~ 4 кПа,
то за рахунок різниці тисків вода надходить із лімфи у кров.
33
Якщо осмотичний тиск одного розчину більший, за іншого, то перший розчин є гіпертонічним, а коли навпаки – то гіпотонічним.
Розчини з однаковим осмотичним тиском називають ізотонічними
Ізотонічність важлива для інфузійних розчинів
У клінічній практиці: ізотонічні розчини мають осмотичний тиск рівний р плазми крові = 7,7 – 8,1 атм
або 0,85-0,9 % натрій хлориду, або 4,5 –5 % розчин глюкози
Фізіологічні розчини за складом подібні морській воді
34
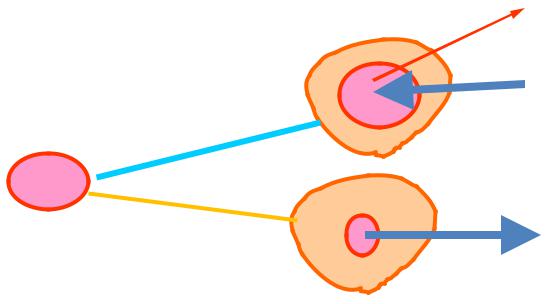
Гемоліз і плазмоліз еритроцитів
Руйнування оболонки еритроцитів при введенні у плазму крові гіпотонічних розчинів супроводжується виходом гемоглобіну в плазму називають гемолізом (―лакова кров‖)
|
Hb |
Гіпотонічний |
Н2О |
розчин |
|
еритроцит |
гемоліз |
Гіпертонічний |
Н2О |
розчин |
|
|
плазмоліз |
Явище зморщування еритроцитів при введенні в
плазму кров гіпертонічних розчинів називають плазмолізом.
35

Буферні розчини, їх складові
Внаслідок перебігу хімічних реакцій йони Гідрогену можуть утворюватися і витрачатися
|
Експериментальні |
|
|
Промислове |
|
|
|
дослідження в: |
|
|
виробництво |
|
|
|
|
|
|
|
|
|
хімії |
|
|
|
|
|
|
|
біології |
Потреба забезпечення сталого |
||||
|
медицині |
|
рН середовища |
|||
Щоб процес відбувався за сталого значення рН, у розчин вводять буферні системи, які підтримують рН середовища практично незмінним.
36

Фізіологічні рідини організму характеризуються сталим значенням рН
фізіологічні механізми фізико-хімічні
За участю органів: Нирки Печінка Легені Кишки
За дії біологічних буферних систем:
У плазмі |
Гідрогенкарбонатна |
крові |
Фосфатна |
|
|
|
Білкова |
|
Гемоглобінова |
Веритроцитах
Уклітинах, сечі та секретах залоз травлення найважливішою є
фосфатна буферна система.
37

Буферними системами називають розчини, які здатні зберігати постійну концентрацію йонів Гідрогену, тобто значення рН середовища, при додаванні до них невеликих кількостей кислоти чи лугу або при розведенні їх.
38
Буферна ємність
Наприклад, при розведенні ацетатного буферу в 100 разів його рН зростає від 4,62 до 4,74, тобто на 0,12.
В
ммоль/л
50
30
10
0
Такі зміни рН слід враховувати при роботі з кров'ю у процесі її біохімічних досліджень, оскільки зміна рН крові навіть на 0,2-0,3 одиниці призводить до серйозних патологічних порушень
|
|
|
|
ммоль |
|
|
|
|
|
||
50 |
100 |
||||
кислота |
|||||
100 |
50 |
0 |
основа |
|
|
|
Залежність буферної ємності від співвідношення компонентів буферного розчину
39

Здатність буферних розчинів зберігати стале значення рН при розведенні або при додаванні кислот чи лугів є обмеженою.
Кількісна міра стійкості буферних систем підтримувати стале значення рН є величиною буферної ємності
Буферною ємністю (В) називають кількість мольеквівалентів сильної кислоти або сильної основи, яку необхідно долити до одного літра буферного розчину, щоб змінити його рН на одиницю.
В=(С·V)/( рН·Vбуф), де С – концентрація кислоти або основи моль/л; V – об'єм
доданого електроліту (л), Vбуф – об'єм буферного розчину (л), рН – зміна рН.
40
