06-09-2014_00-25-24 (1) / Лекция 14
.docxЛекция №14
Полная и полезная разность температур.
N
- число корпусов
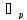 =
=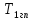 -
- – полная разность температур
– полная разность температур
 =
=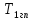 -
- -
- -полезная разность температур
-полезная разность температур
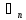 =
= ,
где
,
где
 -движущая сила процесса переноса тепла
в I
корпусе, т.е.
-движущая сила процесса переноса тепла
в I
корпусе, т.е.
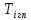 -
- -разность
температур греющего пара .
-разность
температур греющего пара .
Определение поверхности теплообмена корпусов:
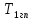

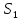
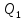

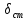



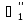
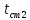

 t1
t1
 +
+ +
+ =
= -
-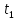
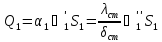 =
= ;
; - коэффициент теплоотдачи от
конденсирующегося пара к стене
- коэффициент теплоотдачи от
конденсирующегося пара к стене
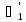 =
=
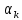 ;
;
 =
=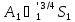 ;
;
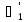 =
= ;
;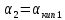 =
=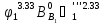 ;
; =
=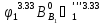 ,
, - коэффициент теплоотдачи от стенки к
кипящей жидкости .Выражаем соответствующие
разности температур и складываем их.
- коэффициент теплоотдачи от стенки к
кипящей жидкости .Выражаем соответствующие
разности температур и складываем их.
 =
=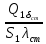 ;
;
 =(
=(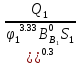
 =(
=( +
+ +(
+(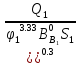 ;
;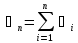 ;
;
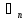 =
=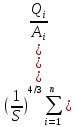 +
+ +
+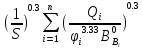 =>f(S)=0
(1) Ищем S
методами однопараметрической оптимизации.
В частности, S
можно определить графически:
=>f(S)=0
(1) Ищем S
методами однопараметрической оптимизации.
В частности, S
можно определить графически:
△ п.ч. л.ч.

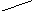

△n
 S
S
△ Л.ч.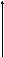



П.ч.



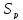 S
S
Где л.ч.- левая часть уравнения (1),п.ч. -правая часть уравнения (1)
Перенос массы
Вывод уравнения неразрывности для многокомпонентной среды.
Уравнение
выводится из закона сохранения массы
i
компонента .Если процесс идет с химическим
превращением, то появляется удельный
источник (сток) массы i
компонента
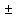
 :
:
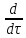 [
[ dV]=
dV]=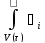 dV
dV
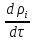 +div(
+div( )=
)=
Пусть имеем n-компонентов:
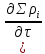 +div(Σ
+div(Σ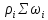 )]
=
)]
= =>
=> – т.е. переходит в уравнение неразрывности
для однокомпонентной среды.
– т.е. переходит в уравнение неразрывности
для однокомпонентной среды.
 =0-
по закону сохранения массы при химических
превращениях.
=0-
по закону сохранения массы при химических
превращениях.
Введем скорость центра масс:
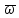 ==
== =
= =>
=>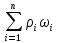 =
= =
=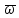 ρ
ρ
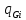 =
= -
поток массы i
компонента
-
поток массы i
компонента
 +div(
+div( )-div(
)-div( )+
div(
)+
div( )=
)=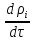 +div[
+div[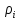 (
( +
div(
+
div(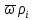 )=
)=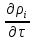 +
div(
+
div( )+div
)+div =
=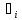 -
уравнение неразрывности для i
компонента.
-
уравнение неразрывности для i
компонента.
Суммируем уравнения неразрывности для всех компонентов:
 +
div(
+
div( )+divΣ
)+divΣ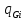 =Σ
=Σ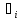
𝛴 =
= -
-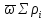 =0;
Σ
=0;
Σ
Получим:
 +
div
+
div =0
–уравнение неразрывности для
однокомпонентной среды
=0
–уравнение неразрывности для
однокомпонентной среды
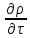 +div(
+div( ρ)=0
- уравнение неразрывности для
многокомпонентной среды
ρ)=0
- уравнение неразрывности для
многокомпонентной среды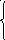
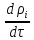 +
div(
+
div( )=
)=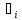 -
div
-
div
Вывод уравнения концентрации
 =
=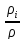 =>
=> =
=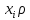 – концентрация ( массовая или мольная).
Тогда из уравнения неразрывности для
многокомпонентной среды получаем:
– концентрация ( массовая или мольная).
Тогда из уравнения неразрывности для
многокомпонентной среды получаем:
ρ[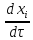 +
+ grad
grad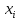 ]+
]+ [
[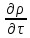 +div
+div ]=-
div
]=-
div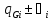 =
=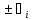 -div
-div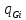
 =[
=[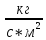 ]=
]=
µ=f(T,P,U,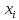 )-химический
потенциал. Это работа образования одного
моля i-компонента.
)-химический
потенциал. Это работа образования одного
моля i-компонента.
 -
поток химического потенциала i-компонента.
-
поток химического потенциала i-компонента.
 =ρ[
=ρ[ (
( )∇
)∇ +
+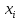 (
( )
∇
)
∇ +
+ (
( )
∇
)
∇ +
+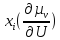 ∇U+…]
∇U+…]
=ρ[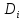 ∇
∇ +
+ ∇T+
∇T+ ∇P+
∇P+ ∇U]=ρ[∇
∇U]=ρ[∇ +
+ ∇T+
∇T+ ∇P+
∇P+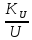 ∇U],
где
∇U],
где
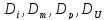 - коэффициенты диффузии, термодиффузии,
бародиффузии, электродиффузии ;
- коэффициенты диффузии, термодиффузии,
бародиффузии, электродиффузии ;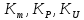 -
термо, баро, электродифузиозные
коэффициенты- результат нормирования
соответствующих коэффициентов различных
видов диффузии i
компонента
-
термо, баро, электродифузиозные
коэффициенты- результат нормирования
соответствующих коэффициентов различных
видов диффузии i
компонента
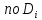
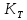 =
=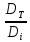 ;
;
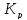 =
= ;
;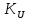 =
=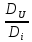
Выражение учитывает сумму потоков массы i компонента, вызванных изменением концентраций температур, давлений, электрических потенциалов и т.д.
ρ[ +
+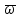 grad
grad ]=
-ρdiv[
]=
-ρdiv[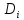 ∇
∇ +
+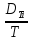 ∇T+
∇T+ ∇P+
∇P+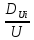 ∇U]
∇U] -уравнение концентрации для i
компонента
-уравнение концентрации для i
компонента
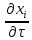 +
+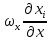 +
+ +
+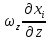 =
-
=
-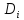 [
[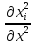 +
+ +
+ ]
]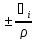 - частный случай уравнения концентрации
i
компонента для изотропных условий и в
пренебрежении другими видами диффузии
в декартовой системе координат (уравнение
Фика).
- частный случай уравнения концентрации
i
компонента для изотропных условий и в
пренебрежении другими видами диффузии
в декартовой системе координат (уравнение
Фика).
В частном случае для стационарного диффузиозного (молекулярного) переноса массы имеем:
div(- grad
grad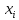 )=0
)=0
-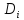 grad
grad =const-закон
Фика
=const-закон
Фика
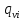 =-
=- grad
grad -удельный объемный поток i
компонента
-удельный объемный поток i
компонента
 =-
=-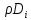 grad
grad -
удельный массовый поток i
компонента
-
удельный массовый поток i
компонента
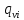 =𝛽△
=𝛽△ =
-
=
-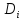 grad
grad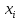 =-
=-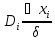 =>
𝛽
=
=>
𝛽
= - коэффициент массоотдачи. Получен по
аналогии с коэффициентом теплоотдачи.
Удельный объемный поток i-го компонента.
- коэффициент массоотдачи. Получен по
аналогии с коэффициентом теплоотдачи.
Удельный объемный поток i-го компонента.
Теория подобия в процессах переноса массы.
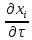 +
+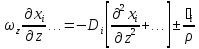
Введем
безразмерные параметры:
 ,
где xi0,
ω0,
z0-характерные
параметры.
,
где xi0,
ω0,
z0-характерные
параметры.
 +
+
Нормируем комплексы характерных параметров при всех членах уравнения по комплексу параметров при диффузионном члене:
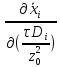 +
+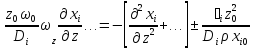
Foд=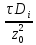 -
диффузионный критерий Фурье (мера
нестационарности процесса);
-
диффузионный критерий Фурье (мера
нестационарности процесса);
Peд=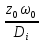 -
диффузионный критерий Пекле (соотношение
конвективного и диффузионного переноса
массы) Peд=
-
диффузионный критерий Пекле (соотношение
конвективного и диффузионного переноса
массы) Peд=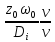 =Re
Prд,
где Prд=
=Re
Prд,
где Prд=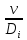 -
диффузионный критерий Прандтля.
-
диффузионный критерий Прандтля.
Po= -
соотношение источника (стока) массы к
диффузионному переносу. Дефузионный
критерий Померанцева.
-
соотношение источника (стока) массы к
диффузионному переносу. Дефузионный
критерий Померанцева.
 +…=-
+…=-
Из
граничного условия аналогичного условию
III рода в теплообмене получаем диффузионный
критерий Био: Biд= .
.
β[xi(τ,0)-xi]=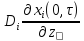 ;
β
;
β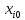 [xi(τ,0)-xi]=
[xi(τ,0)-xi]= ;
Biд[xi(τ,0)-xi]=
;
Biд[xi(τ,0)-xi]=