
Лекции / Лекции (Павлова) / L31
.docЛекция №31.
![]()
Физический смысл: на основе этого уравнения можно определить направленность любого химического процесса (по знаку функции) в прямом и обратном направлениях.

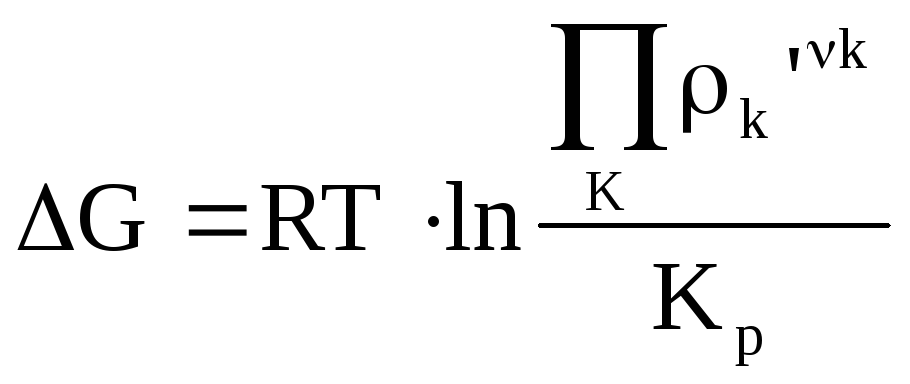

Размерность ∆G и ∆F в этом случае определяется размерностью R, ее можно выражать по-разному.
-
Если ∆G > 0:
Отношение под ln < 1, числитель < знаменателя.
![]()
p’ – неравновесные, задаваемые в начале давления, они определяют направление течения процесса.
В данном случае, процесс протекает в прямом направлении
-
∆G > 0
p’ > pравн реакция протекает в обратном направлении, способств. p исходных веществ.
![]()
-
∆G = 0
р
хим. проц.
медл реакия

![]() ).
).
![]() результ.
= 0
результ.
= 0
Основные выводы из уравнения:
Произведение, стоящее под знаком ln во втором члене уравнения изотермически, по внешнему виду напоминает выражение 3ДМ. Различие только в физическом смысле давлений или концентраций. В Kp или Kc стоят равновесия давлений, с индексами (‘) берут любые произвольные давления или концентрации для исходных веществ и продуктов реакции.
От этих значений будет зависеть величина ∆G и ∆F реакции.
Если исходные давления соответствуют равновесным, то оба члена в скобках будут равны, т.е. это случай (3). Значения ∆G и ∆F химической реакции не зависят от единицы измерения действующих масс.
В отличие от самой константы равновесия, которая является размерной величиной. Знак ∆G указывает направление химической реакции. Если ∆G < 0, то, следовательно, исходящие парциальные давления p продуктов реакции < равновесных и будут стремиться , реакция пойдет слева направо, в прямом направлении.
Если ∆G и ∆F процесса > 0, то исходные парциальные давления > равновесных и реакция пойдет в обратном направлении.
Теоретическое значение константы
равновесия химических реакций может
применяться в
![]() .
Первое значение отвечает случаю, когда
имеется лишь исходные вещества, например,
A и B. (-).
Второй () отвечает
ситуации, когда реакция прошла почти
до конца, до полного израсходования
начальных веществ A и B
и превращения их в конечные продукты,
например C и D.
Следует помнить, что абсолютно чистых
веществ в природе не существует. Все
вещества обладают той или иной степенью
чистоты. Чем чище вещество, тем большей
тенденцией к распаду или взаимосвязью
оно обладает. Процессы с
.
Первое значение отвечает случаю, когда
имеется лишь исходные вещества, например,
A и B. (-).
Второй () отвечает
ситуации, когда реакция прошла почти
до конца, до полного израсходования
начальных веществ A и B
и превращения их в конечные продукты,
например C и D.
Следует помнить, что абсолютно чистых
веществ в природе не существует. Все
вещества обладают той или иной степенью
чистоты. Чем чище вещество, тем большей
тенденцией к распаду или взаимосвязью
оно обладает. Процессы с
![]() значением G в системе
могут …., но не самопроизвольно, и для
их проведения следует затратить энергию.
Для этого данная реакция должна протекать
в сопряжении с другими произвольно
протекающими химическими реакциями, у
которых ∆G и ∆F
> 0. При этом ∆G
и ∆F для всех стадий
сопряженных реакций должна быть
отрицательной.
значением G в системе
могут …., но не самопроизвольно, и для
их проведения следует затратить энергию.
Для этого данная реакция должна протекать
в сопряжении с другими произвольно
протекающими химическими реакциями, у
которых ∆G и ∆F
> 0. При этом ∆G
и ∆F для всех стадий
сопряженных реакций должна быть
отрицательной.
Взаимосвязь между изменениями G и F химических реакций,
протекающих при постоянной T.
G = H – TS
F = U – TS
H = U + PV
∆G = ∆H – T∆S = ∆U +∆(PV) – T∆S
∆F = ∆U – T∆S
∆G = ∆F + ∆(PV)
PV = nRT
∆(PV) = ∆nRT
∆G = ∆F + ∆nRT
∆G = ∆F + ∆(PV)T
Если ∆nгаз = 0, то ∆G = ∆F
Если ∆nгаз 0, то ∆G ∆F (это для газа)
Если жидкость или твердое тело, то ∆G ∆F.
Зависимость K от T. Уравнение изобары и изохоры Вант-Гоффа.
Для получения этих уравнений воспользуемся двумя другими уравнениями:
-
Уравнением Гиббса – Гельмгольца.
-
Уравнением изотермы химической реакции.
1)
![]()
2)
![]()
Для изобарического:
![]() - изотерма.
- изотерма.
Подставим его в ∆G (1) и дифференцируем по T.
Пусть: аА + вВ = сС + dD
![]()
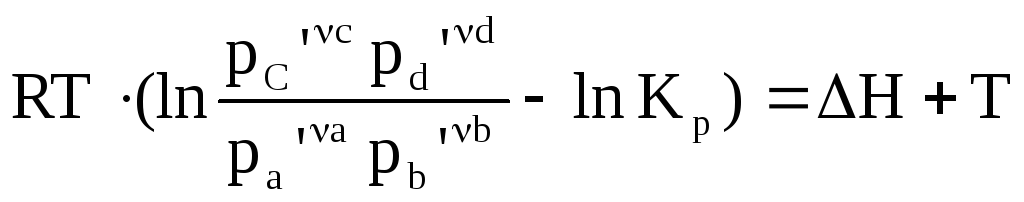



 Дифференцируем:
Дифференцируем:


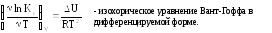
Они дают зависимость ln KP(с) от T. Из этого уравнения следует, что если тепловой эффект химической реакции ∆H(∆U) < 0 (экзотермическая реакция), то K C T .
-
∆
(если > 0, то C T)
эндотермическая
(не зависит от T)
H < 0,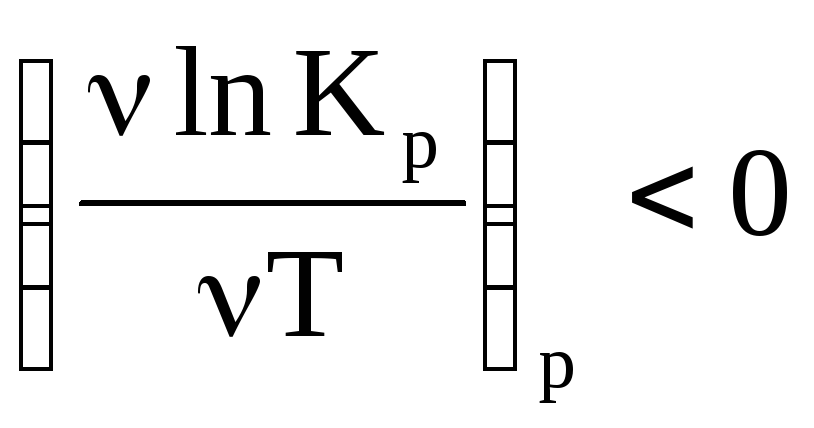
-
∆H > 0,

-
∆H = 0,
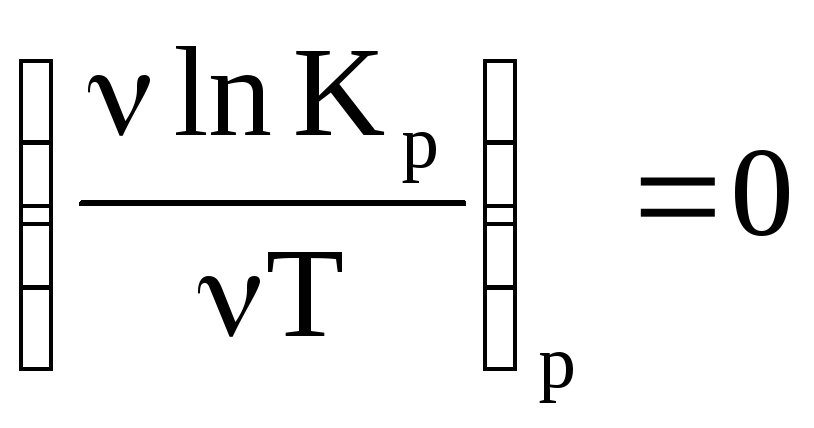
В интегральной форме уравнение позволяет на основании данных по зависимости K(T) рассчитать т/д параметры химических процессов (функции ∆U и ∆S). ∆U и ∆S, если известна зависимость lnKp = (T).
Интегральная форма.
Пусть p const, т.к. К несильно зависит от p.
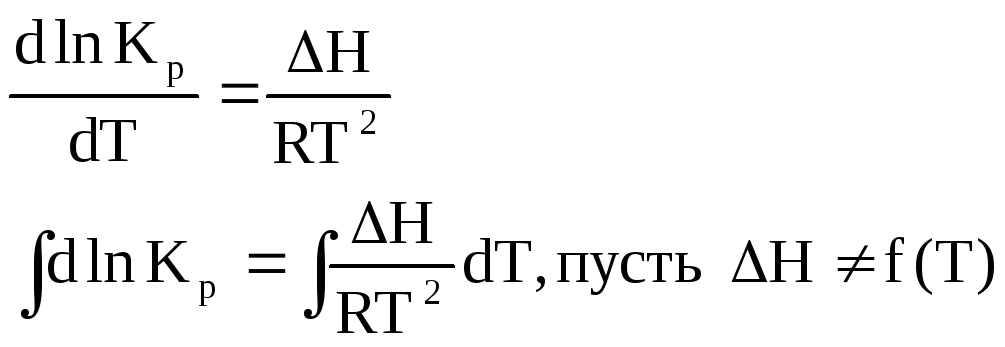

![]()
в чем ее физический смысл?
RTlnKp = -∆H + RTconst
∆G = RT(-lnKp
+ ln![]()
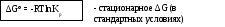 pk’
= 1 атм;
pk’
= 1 атм;
∆G = ∆H - T∆S
![]()

![]()
![]()
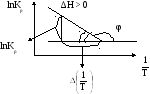
![]()
b = tg < 0
∆H = -Rtg > 0 (эндотермич.)
