
Химия. Лекция № 2 Алканы БАК
.doc
АЛКАНЫ (ПАРАФИНЫ)
Алканами называются органические соединения класса углеводородов обшей формулой: СnH2n+2.
Ряд алканов:
СН4 - метан
С2Н6 (СН3 – СН3) – этан
С3Н8 (СН3 – СН2 – СН3 ) – пропан
С4Н10 (СН3 – (СН2)2 – СН3) – бутан
С5Н12 (СН3 – (СН2)3 – СН3) - пентан
С6Н14 (СН3 – (СН2)4 – СН3) – гексан
С7Н16 (СН3 – (СН2)5 – СН3) – гептан
С8Н18 (СН3 – (СН2)6 – СН3) – октан
С9Н20 (СН3 – (СН2)7 – СН3) – нонан
С10Н22 (СН3 – (СН2)8 – СН3) – декан
Номенклатура (систематическая) – см.практику
Физические свойства
|
№ |
Название алкана |
Агрегатное состояние |
t пл, 0С |
t кип, 0С |
Относительная плотность, d420 |
|
1 |
метан |
газ |
-182 |
-161 |
0,415 |
|
2 |
этан |
газ |
-183 |
-89 |
0,546 |
|
3 |
пропан |
газ |
-188 |
-42 |
0,500 |
|
4 |
бутан |
газ |
-138 |
-0,5 |
0,579 |
|
5 |
изобутан |
газ |
-160 |
-12 |
0,557 |
|
6 |
пентан |
жидкость |
-130 |
36 |
0,626 |
|
7 |
изопентан |
жидкость |
-160 |
28 |
0,620 |
|
8 |
гексан |
жидкость |
-95 |
69 |
0,659 |
|
9 |
гептан |
жидкость |
-91 |
98 |
0,684 |
|
10 |
октан |
жидкость |
-57 |
126 |
0,703 |
|
11 |
нонан |
жидкость |
-51 |
151 |
0,718 |
|
12 |
декан |
жидкость |
-30 |
174 |
0,730 |
Способы получения
-
Промышленные
Из природных источников: нефти, газа
-
лабораторные способы
2.1. без изменения длины цепи
-
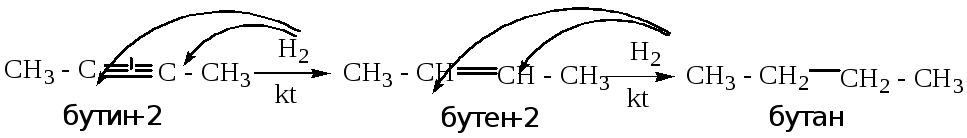
гидрирование алкенов, алкинов (взаимодействие с водородом)
Ненасыщенные углеводороды под действием водорода в присутствии катализатора (никель, палладий, платина) способны к разрыву тройных и двойных связей и образованию алканов.
Пример:
2.2. увеличение длины цепи
2.2.1. Реакция Вюрца (взаимодействие галогеналканов с металлическим натрием)
А) получение симметричных алканов.
В данном случае берется две одинаковых молекулы галогеналкила: при действии металлического натрия, происходит отщепление атомов галогена, с образованием симметричного алкана и соли.
Пример:
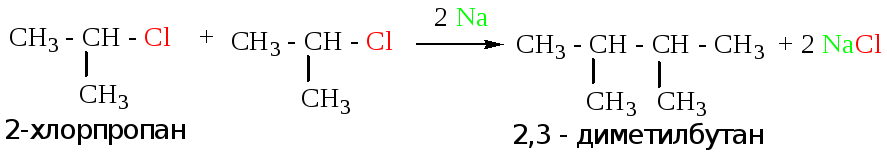
Б) получение несимметричных алканов.
В данном случае берется две разных молекулы галогеналкила: при действии металлического натрия, происходит отщепление атомов галогена, с образованием несимметричного алкана и соли.
Пример:

-
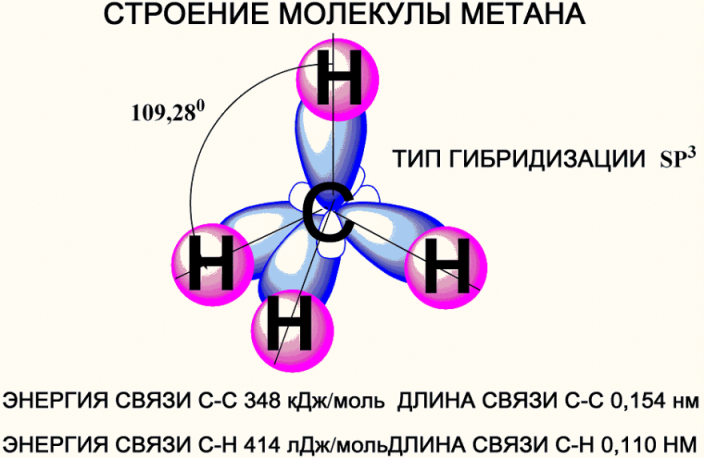
СТРОЕНИЕ МОЛЕКУЛЫ МЕТАНА, ГИБРИДИЗАЦИЯ
Рассмотрим строение молекулы метана. Атом углерода находится в состоянии sp3-гибридизации, т.е. 4 sp3 - гибридные орбитали перекрываются с s –орбиталями атома водорода, и образуют тетраэдр с углом 109028”. Такой тип гибридизации характерен для насыщенных соединений (с одинарными связями) и их радикалов (рис .1).
Характеристика связей в молекуле алкана
|
Тип связи |
Энергия связи, кДж/моль |
Длина связи, нм |
Полярность (дипольный момент), d |
|
С - С |
348 |
0,154 |
0 |
|
С -Н |
414 |
0,110 |
0,3 |
Из таблицы мы видим, что энергия связей достаточно велика, полярность связей низка; тоже самое можно сказать и о поляризуемости. Следовательно:
-
Связи в молекуле алкана достаточно прочны и в обычных условиях алканы - инертные соединения.
2. Разрыв связей происходит гомолитически, с образованиием радикалов.
3. Несмотря на то, что связи «С-Н» прочнее, чем «С-С», разрыв происходит именно по этим связям, так как они более пространственно доступны.
4. Так как все связи в молекуле алкана насышены (одинарны), для этих соединений характерны реакции замещения (замещения радикального ) (см.п.2).
5. Замещение происходит, преимущественно, у менее гидрированного (третичного) атома углерода, вследствие большей стабильности образующегося радикала.
-
Химические свойства
Для алканов характерны следующие основные типы реакций.
4.1 Радикальное замещение (SR).
4.1.1. Галогенирование.
В обычных условиях алканы в нее не вступают.
Реакция протекает при высоких температурах и УФ-облучении. Фтор дает при взаимодействии с алканами взрыв, с йодом реакция не идет. Замещение протекает, преимущественно, у третичного атома углерода.
Пример:

4.1.2. Нитрование (реакция Коновалова)
Реакция нитрования протекает в присутствии разбавленной (10-20%) азотной кислоты, при нагревании. Замещение так же производится преимущественно у третичного атома углерода.
Пример:

