
pg_met_pr2
.pdf
Розглянемо уявний випадок, коли зміна ентропії дорівнюватиме нулю S = 0 . Коли врахувати, що при цьому також не змінюється і температура, то можемо зробити висновок, що газ перебуває у рівноважному стані, розширення не відбувається, відношення відповідних об’ємів дорівнює
одиниці V2 /V1 =1. |
З |
розрахункової |
формули |
|
випливає |
такий |
||||||
|
|
|
|
|
V |
æ DS |
ö |
|
|
æ 0 |
ö |
|
самий результат. Коли |
S = 0 , то |
2 |
= expç |
÷ |
= expç |
|
÷ =1. |
|||||
V1 |
|
|||||||||||
|
|
|
|
|
è nR |
ø |
|
|
è nR |
ø |
||
Отже, розрахункова формула не суперечить фізичним |
||||||||||||
міркуванням. |
|
|
|
|
|
|
|
|
|
|
||
|
V |
æ DS ö |
|
|
|
|
|
|
|
|
||
Відповідь: |
2 |
= expç |
÷ = 2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
V1 |
è nR ø |
|
|
|
|
|
|
|
|
||
Приклад 3.5 |
|
|
|
|
|
|
|
|
|
|
||
Два балони ємністю V1 = V2 =1л |
кожний з’єднані трубкою з |
|||||||||||
краном. Один із них містить водень під тиском |
p =105 Па при |
|||||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
температурі |
T = 293К , інший – гелій під тиском p |
2 |
= 3×105 Па |
|||||||||
|
1 |
|
|
|
|
|
|
|
|
|
||
при температурі T2 = 373К . Знайти зміну ентропії системи S
після відкриття крана та досягнення рівноважного стану. Стінки балона та трубки забезпечують повну теплову ізоляцію від зовнішнього середовища.
S -?
V1 =1л=×10-3м3, V2 =1л=×10-3м3, p1 =1×105 Па,
p2 =3×105 Па,
T1 =×293К,
T2 =373К
даної задачі.
Розв’язання
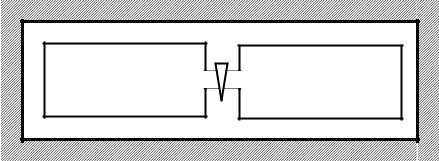
Після відкривання крана водень та гелій рівномірно розподіляться в системі двох посудин (див. рис. 3.3). При цьому завдяки перемішуванню газів установляться рівноважна температура T та рівноважний тиск p . Детально процеси, які при цьому
відбуваються, описані в прикладі 2.5. У цьому самому прикладі знайдені параметри кінцевого стану, які ми використаємо для розв’язання
71
A |
B |
|
T1 p1 V1 m1 μ1 g1 |
T2 p2 V2 m2 |
μ2 g2 |
Рисунок 3.3
Слід зазначити, що процес перемішування газів є необоротним процесом. Зворотний до перемішування процес самовільно проходити не може. Тому безпосередньо застосувати формулу (2.3в) до даної задачі ми не можемо. Але ми можемо процес перемішування розглядати як сукупність двох процесів: 1) квазістатичного розширення водню від початкової температури T1 , об’єму V1 до кінцевого об’єму
V1 +V2 й рівноважної температури T ; 2) квазістатичного розширення гелію від початкової температури T2 , об’єму V2 до кінцевого об’єму V1 +V2 й рівноважної температури T . Кожний
з цих окремих процесів є квазістатичним, а отже, і оборотним. До кожного з цих процесів маємо право застосувати формулу (2.3в), а отже, і формулу (4) з прикладу 3.4, і знайти зміну ентропії для водню DS1 і зміну ентропії для гелію DS2 . Загальна
ж зміна ентропії системи буде визначатись співвідношенням
DS = DS1 + DS2 . |
(1) |
Реалізуємо вищевикладений план розв’язання задачі. Для того щоб знайти зміну ентропії для водню та гелію, використаємо формулу (4) прикладу 3.4 і отримаємо
|
n1R |
æ |
T |
ö |
æ |
|
ö |
|
|
||
|
ç |
÷ |
çV2 |
+V1 |
÷ |
, |
(2) |
||||
|
|
|
|||||||||
DS1 = g |
1 |
-1lnç T |
÷ |
+ n1R lnç |
V |
÷ |
|||||
|
|
|
è |
1 |
ø |
è |
1 |
ø |
|
|
|
72
|
n2 R |
æ |
T |
ö |
æ |
|
ö |
|
||
|
ç |
÷ |
çV2 +V1 |
÷ |
(3) |
|||||
|
|
|
||||||||
DS2 = g |
2 |
-1lnç T |
÷ |
+ n2 R lnç |
V |
÷ . |
||||
|
|
|
è 2 |
ø |
è |
2 |
ø |
|
||
У цих формулах n1, n2 |
- |
кількість молів відповідно водню та |
||||||||
гелію; g1, g2 - стала адіабати відповідно водню та гелію; |
T - |
|||||||||
рівноважна температура, яка визначається формулою (10) прикладу 2.5:
é p1V1 |
p2V2 ù é |
p1V1 |
|
|
|
p2V2 |
ù |
|
|||||||||||||||||
T = ê |
|
|
|
+ |
|
|
|
|
ú |
/ê |
|
|
|
|
+ |
|
|
|
|
ú . |
(4) |
||||
g |
1 |
-1 |
g |
2 |
-1 |
T (g |
1 |
-1) |
T (g |
2 |
-1) |
||||||||||||||
ë |
|
|
|
|
û |
ë |
|
1 |
|
|
|
2 |
|
û |
|
||||||||||
Як відомо, водень є двоатомним газом і тому має 5 ступенів |
|||||||||||||||||||||||||
вільності ( i1 = 5 ). Для цього газу стала адіабати дорівнює |
|||||||||||||||||||||||||
|
|
|
|
g1 |
= |
|
i1 + 2 |
= |
5 + 2 |
|
=1,4. |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
i1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Гелій є одноатомним |
газом |
|
і |
|
тому |
має 3 |
ступені |
вільності |
|||||||||||||||||
( i2 = 3). Для цього газу стала адіабати дорівнює |
|
|
|
||||||||||||||||||||||
|
|
|
g2 |
= i2 + 2 = |
3+ 2 »1,67. |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
i2 |
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
Кількість молей водню та гелію знайдемо, використовуючи |
|||||||||||||||||||||||||
для цих газів рівняння Менделєєва-Клапейрона (2.1а): |
|
||||||||||||||||||||||||
|
|
|
p1V1 = n1RT1, |
|
p2V2 = n2RT2. |
|
|
|
|
||||||||||||||||
Звідси |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n = |
p1V1 |
, |
|
n |
2 |
= |
p2V2 |
. |
|
|
|
(5) |
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
1 |
|
|
|
RT1 |
|
|
|
|
|
|
|
RT2 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Підставляємо (5) і (4) в (2) та (3), а потім у формулу (1). У результаті перетворень знаходимо шукану зміну ентропії:
73
|
p1V1 |
|
R |
æ |
ö |
|
p1V1 |
æ |
|
+V2 |
ö |
|
|
|
ç T |
÷ |
|
çV1 |
÷ |
|
|||||
DS = DS1 + DS2 = |
|
|
|
lnç T |
÷ |
+ |
|
R lnç |
|
|
÷ |
+ |
RT |
(g -1) |
RT |
|
V |
||||||||
|
1 |
1 |
è 1 |
ø |
|
1 |
è |
|
1 |
ø |
|
|
|
|
|
|
p2V2 |
|
|
|
R |
æ |
T |
ö |
|
|
p2V2 |
|
æ |
|
+V2 |
ö |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
ç |
÷ |
|
|
|
çV1 |
÷ |
|
|
|
|
|
|
|
|||||||||||||||||
|
+ |
|
|
|
|
|
|
|
lnç |
|
|
÷ |
+ |
|
|
|
R lnç |
|
|
|
|
÷, |
|
|
|
|
|
|
|||||||||
|
|
RT |
|
(g |
2 |
-1) |
T |
|
RT |
|
|
V |
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
è |
|
2 |
|
ø |
|
|
|
2 |
|
|
è |
|
2 |
|
ø |
|
|
|
|
|
|
|
||
|
|
p V |
æ ln(T /T ) |
|
|
æV +V |
öö |
|
p V |
æ ln(T /T ) |
|
æV +V |
öö |
||||||||||||||||||||||||
DS = |
|
|
1 1 |
ç |
|
|
|
|
|
1 |
|
|
+ ln |
ç |
|
1 |
2 |
÷÷ |
+ |
2 2 |
ç |
|
|
|
2 |
|
+ ln |
ç |
1 |
2 |
÷÷ |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
T |
ç |
|
|
g |
|
|
-1 |
|
|
ç |
|
|
V |
÷÷ |
T |
ç |
|
g |
|
-1 |
|
ç |
|
V |
. |
||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
÷÷ |
|||||||||||||||||||
|
|
|
1 |
è |
|
|
|
|
|
|
|
|
è |
|
|
|
1 |
øø |
|
2 |
è |
|
|
|
|
|
è |
|
2 |
øø |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(6) |
У формулі (6) рівноважна температура визначається виразом (4).
Аналіз отриманого результату
1 Перевіримо, чи дає розрахункова формула (6) правильну одиницю вимірювання шуканої фізичної величини. Для цього в праву й ліву частини цього співвідношення замість символів
фізичних величин підставимо їх одиниці вимірювання. |
|
|
|
|
|||||||||||||||||||
|
Зрозуміло, що [ |
S] =Дж/К. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
З іншого боку, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
é p V |
æ ln(T /T ) |
æV +V |
ö |
ö |
|
|
p V |
æ ln(T /T ) |
æV +V |
ö |
öù |
|
|||||||||||
ê |
1 1 |
ç |
|
|
1 |
+ lnç |
1 2 |
÷ |
÷ |
+ |
|
2 2 |
ç |
|
|
2 |
+ lnç |
1 |
2 |
÷ |
÷ú |
= |
|
T |
g |
|
V |
|
T |
g |
|
|
V |
||||||||||||||
ê |
ç |
1 |
-1 |
ç |
÷ |
÷ |
|
|
ç |
2 |
-1 |
ç |
|
÷ |
÷ |
ú |
|
||||||
1 |
è |
|
|
è |
1 |
ø |
ø |
|
|
2 |
è |
|
|
è |
|
2 |
ø |
|
|
||||
ë |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
øû |
|
||||
=Па ×м3 = Дж .
КК
Тобто Дж/К=Дж/К. Таким чином, розрахункова формула (6) дає правильні одиниці вимірювання.
2 Запишемо фізичні величини, що входять в розрахункову формулу (6), в одиницях СІ й виконаємо обчислення:
é |
p1V1 |
|
p2V2 |
ù |
é |
p1V1 |
|
p2V2 |
ù |
= |
||||||||
T = ê |
|
|
|
+ |
|
|
|
ú |
/ê |
|
|
|
+ |
|
|
|
ú |
|
g |
1 |
-1 |
g |
2 |
-1 |
T (g |
1 |
-1) |
T (g |
2 |
-1) |
|||||||
ë |
|
|
|
|
|
û |
ë |
1 |
|
2 |
|
û |
|
|||||
74
|
æ |
1×105 ×1×10−3 |
|
3×105 |
|
×1×10−3 |
ö |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
ç |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
÷ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
ç |
|
|
1,4 |
-1 |
|
|
|
|
|
|
|
|
1,67 -1 |
|
÷ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
= |
|
è |
|
|
|
|
|
|
|
|
|
|
|
|
|
ø |
К = 340 К, |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
æ |
1×105 ×1×10−3 |
|
3×105 |
|
×1×10−3 |
ö |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
ç |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
÷ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
ç |
293×(1,4 -1) |
|
|
|
|
|
|
|
|
|
|
|
÷ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
è |
|
373×(1,67 -1) ø |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
p V |
æ ln(T /T ) |
|
æV +V |
öö |
|
|
|
p V |
æ ln(T /T ) |
æV +V |
öö |
|
|||||||||||||||||||||||||||||||
DS = |
1 1 |
ç |
|
|
|
|
|
|
|
1 |
|
+ lnç |
1 |
2 |
÷÷ |
+ |
|
|
2 2 |
ç |
|
|
|
|
2 |
|
+ lnç |
1 |
2 |
÷÷ |
= |
|||||||||||||||||
T |
|
|
g |
|
|
|
|
|
|
|
|
|
|
T |
|
|
g |
|
-1 |
|
V |
|||||||||||||||||||||||||||
|
|
|
|
|
ç |
|
|
1 |
-1 |
|
|
|
ç |
|
|
V |
÷÷ |
|
|
|
ç |
|
|
2 |
|
ç |
|
÷÷ |
|
|||||||||||||||||||
|
|
|
|
|
1 |
è |
|
|
|
|
|
|
|
|
|
è |
|
|
1 |
øø |
|
|
|
|
2 |
|
è |
|
|
|
|
|
è |
|
2 |
øø |
|
|||||||||||
|
105 ×10−3 æ ln(340/ 293) |
|
|
|
æ10−3 +10−3 öö |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
= |
|
|
|
|
|
|
ç |
|
|
|
|
|
|
|
|
|
|
|
+ lnç |
|
|
|
|
|
|
|
|
|
|
|
|
÷÷ |
+ |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
−3 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
293 |
ç |
|
|
|
|
1,4 -1 |
|
|
|
|
ç |
|
10 |
|
÷÷ |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
è |
|
|
|
|
|
|
|
|
è |
|
|
|
|
øø |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
3×105 ×10−3 æ ln(340/373) |
|
|
æ10−3 |
+10−3 öö |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
+ |
|
|
|
|
|
|
|
|
|
ç |
|
|
|
|
|
|
|
|
|
|
|
+ ln |
ç |
|
|
|
|
|
|
|
|
|
|
÷÷ |
Дж/К=0,81 Дж/К. |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
−3 |
|
|
|
|||||||||||||||||||
|
|
|
|
|
373 |
|
|
|
|
ç |
|
|
1,67 -1 |
|
|
|
|
ç |
|
|
|
10 |
|
÷÷ |
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
è |
|
|
|
|
|
|
è |
|
|
|
|
|
|
øø |
|
|
|
|
|
|
|
|
|||||||||||||||||
3 Проаналізуємо отриману розрахункову формулу (6). Слід зазначити, що гази знаходяться в теплоізольованій оболонці. Тому відповідно до другого закону термодинаміки у цьому випадку ентропія не може зменшуватись, вона може тільки збільшуватись або не змінюватись. Тобто DS ³ 0 . У результаті розрахунків ми отримали, що S =+0,8 Дж/К. Це задовольняє умову DS ³ 0 . Отже, отриманий результат не суперечить другому закону термодинаміки.
Відповідь:
|
p V |
æ ln(T /T ) |
|
|
|
æV +V |
öö |
|
|
|
p V |
|
æ ln(T /T ) |
|
|
æV +V |
öö |
|
|||||||||||||||||||||
DS = |
1 1 |
ç |
|
|
1 |
+ lnç |
|
1 |
|
|
2 |
÷÷ |
+ |
|
|
2 2 |
|
ç |
|
|
|
2 |
|
|
+ lnç |
|
1 2 |
÷÷ |
= |
||||||||||
T |
g |
|
-1 |
|
V |
|
|
|
|
T |
|
|
g |
|
-1 |
|
|
|
|
||||||||||||||||||||
|
ç |
1 |
|
|
|
ç |
|
|
|
÷÷ |
|
|
|
|
ç |
|
2 |
|
|
|
|
ç |
|
|
V |
÷÷ |
|
||||||||||||
|
1 |
è |
|
|
|
|
|
è |
|
1 |
|
|
øø |
|
|
|
|
2 |
è |
|
|
|
|
|
|
|
|
è |
|
|
2 |
øø |
|
||||||
=0,81 Дж/К, де T = |
é |
p1V1 |
+ |
p2V2 ù |
|
é |
p1V1 |
|
+ |
|
p2V2 |
ù |
=340 К. |
||||||||||||||||||||||||||
ê |
|
|
|
|
|
|
ú |
/ê |
|
|
|
|
|
|
|
ú |
|||||||||||||||||||||||
g |
1 |
-1 |
g |
2 |
-1 |
T (g |
1 |
-1) |
T (g |
2 |
-1) |
||||||||||||||||||||||||||||
|
|
|
|
|
|
ë |
|
|
|
|
|
|
û |
|
ë |
1 |
|
|
|
|
2 |
|
|
|
|
|
û |
|
|
|
|||||||||
75
3.2 |
Задачі для самостійного розв’язання |
|
3.1 |
У результаті кругового процесу газ виконав роботу |
|
А=1 Дж і передав холодильнику кількість теплоти Q′ |
=4,2 Дж. |
|
|
2 |
|
Визначити ККД циклу η.
3.2Виконавши замкнений цикл, газ отримав від нагрівача
кількість теплоти Q1=4 кДж. Визначити роботу А газу в цьому циклі, коли його ККД η =0,1.
3.3Ідеальний двоатомний газ, кількість якого ν =1 моль, виконує цикл, що складається з двох ізохор і двох ізобар.
Найменший об'єм Vmin=l0 л, найбільший Vmax=20 л, найменший тиск pmin=246 кПа, найбільший pmax=410 кПа. Побудувати графік
циклу. Визначити температуру Т газу для характерних точок циклу і його ККД η.
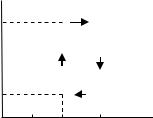
3.4 1 кмоль |
|
ідеального |
|
|
p , кПа |
|
|
|
|
|
|||
двоатомного |
газу |
виконує |
16 |
|
|
2 |
|
|
|
3 |
|||
|
|
|
|
|
|||||||||
замкнений цикл, графік якого |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||
зображений на рис. 3.4. Визначити: |
|
|
|
|
|
|
|
|
|
||||
1) кількість теплоти |
Q1, яку |
газ |
12 |
|
|
1 |
|
|
|
|
4 |
||
отримав від нагрівача; 2) кількість |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||||
теплоти |
Q′ , |
яку |
передано |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
2 |
|
|
|
|
|
|
1 |
2 |
3 |
V , |
||
холодильнику; 3) роботу А, яку |
|
|
|
||||||||||
|
|
|
Рисунок 3.4 |
м |
|||||||||
виконано газом за цикл; 4) ККД η |
|
|
|
||||||||||
циклу. |
|
|
|
|
|
|
|
|
|
|
|
|
|
3.5 Ідеальний |
двоатомний |
газ, |
що |
містить |
кількість |
||||||||
речовини ν |
=1 моль і знаходиться під тиском p1=0,1 МПа при |
||||||||||||
температурі T1=300 К, нагрівають при постійному об'ємі до тиску p2=0,2 МПа. Після цього газ ізотермічно розширяють до початкового тиску і потім ізобарично стискають до початкового об'єму V1. Побудувати графік циклу. Визначити температуру Т газу для характерних точок циклу і його ККД η.
3.6 Одноатомний газ, що містить кількість речовини ν =0,1 кмоль, під тиском p1=100 кПа займає об'єм V1=5 м3. Потім газ стискають ізобарично до об'єму V2=1 м3, далі стискають адіабатично і розширяють при постійній температурі до
76
початкових об'єму і тиску. Побудувати графік процесу. Знайти: 1) температури T1, T2, об'єми V1, V2 і тиск p3, який відповідає характерним точкам циклу; 2) кількість теплоти Q1, яку отримано газом від нагрівача; 3) кількість теплоти Q2′ , яку
передано газом охолоджувачу; 4) роботу А, яку виконано газом за весь цикл; 5) термічний ККД η циклу.
3.7Ідеальний багатоатомний газ виконує цикл, що складається з двох ізохор і двох ізобар, причому найбільший тиск газу в два рази більше від найменшого, а найбільший об'єм
учотири рази більше від найменшого. Визначити ККД η циклу.
3.8Ідеальний газ виконує цикл Карно. Температура T2 охолоджувача дорівнює 290 К. У скільки разів збільшиться ККД
циклу, якщо температура нагрівача підвищиться від T1′ =400 К
до T1′′ =600 К?
3.9Ідеальний газ виконує цикл Карно. Температура T1 нагрівача в три рази вище за температуру Т2 охолоджувача. Нагрівач передав газу кількість теплоти Q1=42 кДж. Яку роботу
Авиконав газ?
3.10Ідеальний газ виконує цикл Карно. Температура T1 нагрівача дорівнює 470 К, температура Т2 охолоджувача дорівнює 280 К. При ізотермічному розширенні газ виконує роботу A=100 Дж. Визначити ККД η циклу, а також кількість
теплоти Q2′ , яку газ віддає охолоджувачу при ізотермічному стисканні.
3.11Ідеальний газ виконує цикл Карно. Температура T1 нагрівача в чотири рази вище за температуру Т2 охолоджувача. Яку частку ω кількості теплоти, одержаної за один цикл від нагрівача, газ віддає охолоджувачу?
3.12Ідеальний газ, який виконує цикл Карно, отримав від
нагрівача кількість теплоти Q1=4,2 кДж і виконав роботу А=590 Дж. Знайти ККД η цього циклу. У скільки разів температура T1 нагрівача більше температури Т2 охолоджувача?
77

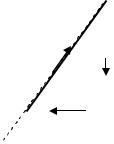
3.13 Ідеальний двоатом- |
p |
A |
|
||||
ний газ виконує цикл Карно, |
|
|
|
|
|||
графік якого зображений на |
|
|
B |
|
|||
рис. 3.5. Об'єми газу в станах |
|
|
|
||||
|
|
|
|
||||
В і С відповідно V1=12 л і |
|
|
|
|
|||
V2=16 л. Знайти ККД η |
|
|
D |
|
|||
циклу. |
|
|
|
|
C |
||
3.14 Ідеальний |
газ |
|
|
|
|||
|
|
|
V |
||||
виконує цикл Карно. Робота |
|
|
|
|
|||
O |
V1 |
V |
|||||
A1 ізотермічного розширення |
|||||||
|
|
|
2 |
||||
газу дорівнює 5 Дж. |
|
|
Рисунок 3.5 |
|
|||
Визначити |
роботу |
A2 |
|
|
|
|
|
ізотермічного стискання, якщо ККД η циклу дорівнює 0,2.
3.15Найменший об'єм V1 газу, що виконує цикл Карно, дорівнює 153 л. Визначити найбільший об'єм V3, якщо об’єм V2
вкінці ізотермічного розширення і об’єм V4 в кінці ізотермічного стискання дорівнюють відповідно 600 і 189 л.
3.16Змішали воду масою m1=5 кг при температурі T1=280 К з водою масою m2=8 кг при температурі Т2=350 К. Знайти: 1)
температуру T суміші; 2) зміну S ентропії, що має місце при змішуванні.
3.17 У результаті ізохорного нагрівання водню масою m=1 г тиск р газу збільшився в два рази. Визначити зміну S ентропії газу.
3.18Знайти зміну S ентропії при ізобарному розширенні азоту масою m=4 г від об'єму V1=5 л до об'єму V2=9 л.
3.19Лід масою m=200 г, узятий при температурі t1= −10 °С, був нагрітий до температури t2=0 °С і розплавлений. Вода, що
після цього утворилася, була нагріта до температури t=10°С. Визначити зміну S ентропії в ході зазначених процесів.
3.20 Лід масою m1=2 кг при температурі t1=0°С був перетворений на воду тієї самої температури за допомогою пари, що має температуру t2=100°С. Визначити масу m2 витраченої пари. Яка зміна S ентропії системи лід – пара?
78

3.21Кисень масою m=2 кг збільшив свій об'єм в n=5 разів: один раз ізотермічно, інший – адіабатично. Знайти зміни ентропії в кожному із зазначених процесів.
3.22Водень масою m=100 г був ізобарично нагрітий так, що об'єм його збільшився в n=3 разів, потім водень був ізохорно охолоджений так, що тиск його зменшився в n=3 разів. Знайти
зміну S ентропії в ході зазначених процесів.
3.23 В якому випадку ККД циклу Карно |
підвищиться |
більше: при збільшенні температури нагрівача на |
T або при |
зменшенні температури холодильника на таку саму величину? 3.24 Водень виконує цикл Карно. Знайти ККД циклу, якщо
при адіабатичному розширенні: |
а) об'єм газу збільшується в |
||||||
n =2,0 рази; б) тиск зменшується в п=2,0 рази. |
|
|
|||||
3.25 Ідеальний |
газ |
p |
|
|
|
|
|
|
|
|
|||||
виконує цикл, що складається |
|
|
T1 |
|
|
||
з чергування ізотерм і адіабат |
|
|
|
|
|
||
(рис. 3.6). Температури, при |
|
|
|
T2 |
|||
яких відбуваються ізотермічні |
|
|
|
||||
процеси, дорівнюють T1 , T2 і |
|
|
|
|
|
||
T3 . Знайти ККД такого циклу, |
|
|
T |
|
|
||
якщо |
при |
кожному |
|
|
3 |
|
|
|
|
|
|
|
|||
|
|
|
V |
||||
ізотермічному |
розширенні |
O |
|||||
об'єм газу збільшується в одну |
Рисунок 3.6 |
|
і ту саму кількість разів. |
||
|
3.26 Знайти ККД циклу, що складається з двох ізохор і двох адіабат, якщо в межах циклу
об'єм ідеального газу змінюється в п=10 разів. Робочою речовиною є азот.
3.27 Ідеальний газ із показником адіабати γ виконує цикл, що складається з двох ізохор і двох ізобар. Знайти ККД такого циклу, якщо абсолютна температура газу зростає в п разів як при ізохорному нагріванні, так і при ізобаричному розширенні.
79
3.28Ідеальний газ виконує цикл, що складається з: а) ізохори, адіабати і ізотерми; б) ізобари, адіабати і ізотерми, причому ізотермічний процес відбувається при мінімальній температурі циклу. Знайти ККД кожного циклу, якщо абсолютна температура в його межах змінюється в п разів.
3.29Ідеальний газ виконує цикл, що складається з ізотерми, політропи і адіабати, причому ізотермічний процес відбувається при максимальній температурі циклу. Знайти ККД такого циклу, якщо абсолютна температура в його межах змінюється в п разів.
3.30Ідеальний газ із показником адіабати γ виконує прямий цикл, що складається з адіабати, ізобари і ізохори. Знайти ККД циклу, якщо при адіабатичному процесі об'єм ідеального газу: а) збільшується в п разів; б) зменшується в п разів.
3.31Обчислити ККД циклу, що складається з ізотерми, ізобари і ізохори, якщо при ізотермічному процесі об'єм ідеального газу з показником адіабати γ: а) збільшується в п раз; б) зменшується в п раз.
3.32Знайти ККД циклу, що складається з двох ізохор і двох ізотерм, якщо в межах циклу об'єм змінюється в ν разів, а абсолютна температура — в τ разів. Робочою речовиною є ідеальний газ із показником адіабати γ.
3.33 Ідеальний газ із |
|
показником |
p |
|
|
|
|
|
||
|
|
|
|
|
||||||
адіабати γ виконує цикл (рис. 3.7), у |
|
|
|
|
|
|
||||
межах якого |
абсолютна |
температура |
|
|
|
|
|
|
||
змінюється в τ разів. Знайти ККД |
|
|
|
|
|
|
||||
цього циклу. |
|
|
|
|
|
|
|
|
|
|
3.34 Знайти |
приріст |
ентропії |
|
|
|
|
|
|
||
одного моля вуглекислого газу при |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|||||
збільшенні |
|
його |
|
абсолютної |
|
|
|
|
|
|
температури |
в |
n =2,0 |
рази, якщо |
|
|
|
|
|
|
|
O |
|
|
V |
|||||||
процес нагрівання: а) |
ізохоричний; |
|
|
|
Рисунок 3.7 |
|||||
б) ізобаричний. |
Газ |
|
вважати |
|
|
|
||||
ідеальним.
3.35 Визначити ККД циклу, що складається з двох ізобар і двох ізотерм, якщо в межах циклу тиск змінюється в n разів, а
80
