
pg_met_pr2
.pdf
абсолютна температура — в τ раз. Робочою речовиною є ідеальний газ із показником адіабати γ.
3.36Два молі ідеального газу спочатку ізохорично охолодили, а потім ізобарично розширили так, що температура газу стала дорівнювати початковій. Знайти приріст ентропії газу, якщо його тиск у даному процесі змінився в п=3,3 рази.
3.37Гелій масою т=1,7 г адіабатично розширили в п=3,0 рази і потім ізобарично стиснули до початкового об'єму. Знайти приріст ентропії газу в цьому процесі.
3.38Знайти приріст ентропії ν =2,0 молів ідеального газу з показником адіабати γ=1,30, якщо в результаті деякого процесу об'єм газу збільшився в α=2,0 рази, а тиск зменшився в β=3,0 рази.
3.39У посудинах 1 і 2 міститься по ν =1,2 моля
газоподібного гелію. Відношення об'ємів посудин V2  V1 = α = 2,
V1 = α = 2,
а |
відношення |
абсолютних |
температур |
гелію |
в них |
T1 |
T2 = β = 1,5. |
Вважаючи газ |
ідеальним, |
знайти |
різницю |
ентропії гелію в цих посудинах (S2 − S1 ). |
|
|
|||
3.40Один моль ідеального газу з показником адіабати γ виконує політропічний процес, у результаті якого абсолютна температура газу збільшується в τ разів. Показник політропи п. Знайти приріст ентропії газу в даному процесі.
3.41Процес розширення ν =2,0 молів аргону відбувається так, що тиск газу збільшується прямо пропорційно його об'єму. Знайти приріст ентропії газу при збільшенні його об'єму в α=2,0 рази.
3.42Ідеальний газ із показником адіабати γ виконує процес
за законом p = p0 − αV , де р0 і α — додатні сталі; V — об’єм.
При якому значенні об'єму ентропія газу буде максимальною? 3.43 Один моль ідеального газу виконує процес, при якому
ентропія газу |
змінюється |
з |
температурою Т |
за |
законом |
|
S = aT + CV ln T , |
де |
а — |
додатна стала; CV |
— |
молярна |
|
теплоємність даного |
газу |
при |
постійному об'ємі. |
Знайти, як |
||
81
залежить температура газу від його об'єму в цьому процесі, якщо при V= V0 температура Т=Т0.
3.44 У деякому процесі температура речовини залежить від
його ентропії S за законом T = aSn , де а і n — постійні. Знайти відповідну теплоємність С речовини як функцію S . При якій умові С < 0?
3.45 Знайти температуру Т як функцію ентропії S речовини для політропічного процесу, при якому теплоємність речовини дорівнює С. Відомо, що при температурі Т0 ентропія речовини дорівнює S0 . Зобразити наближені графіки залежності Т( S ) при
С>0 і С < 0.
3.46 Один моль ідеального |
газу з відомим |
значенням |
теплоємності CV виконує процес, при якому його ентропія S |
||
залежить від температури Т як |
S = α /T , де α — |
постійна. |
Температура газу змінилася від |
T1 до T2 . Знайти: а) молярну |
|
теплоємність газу як функцію його температури; б) кількість тепла, яку надано газу; в) роботу, яку виконав газ.
3.47 Робоча |
T |
|
|
T |
|
|
|
|||||
|
|
|
|
|||||||||
|
|
|||||||||||
речовина виконує |
|
|
|
|
|
|
|
|
|
|
||
цикл, |
у межах |
|
|
|
|
|
|
|
|
|
|
|
якого |
абсолютна |
|
|
|
|
|
|
|
|
|
|
|
температура |
в п |
|
|
|
|
|
|
|
|
|
|
|
змінюється |
|
|
S |
|
|
|
|
|
|
|
||
раз, а сам цикл |
|
|
|
|
S |
|
|
|||||
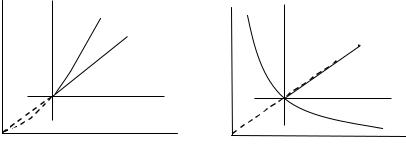
має вигляд, |
який |
Рисунок 3.8а |
Рисунок 3.8б |
|
||||||||
показано: а) на |
|
|
|
|
|
|
|
|
|
|
||
рис. 3.8а; б) на рис. 3.8б, де Т — абсолютна температура; S |
— |
|||||||||||
ентропія. Знайти ККД кожного циклу. |
|
|
|
|
|
|
|
|||||
3.48 Ідеальний |
газ у кількості ν =2,2 |
моля знаходиться |
в |
|||||||||
одній із двох термоізольованих посудин, з’єднаних між собою трубкою з краном. В іншій посудині — вакуум. Кран відкрили і газ заповнив обидві посудини, збільшивши свій об'єм в п=3,0 разів. Знайти приріст ентропії газу.
82
3.49Термоізольований циліндр поділений невагомим поршнем на дві однакові частини. По один бік поршня знаходиться один моль ідеального газу з показником адіабати γ,
апо інший — вакуум. Початкова температура газу Т0. Поршень відпустили і газ заповнив весь циліндр. Потім поршень повільно перемістили в початкове положення. Знайти приріст внутрішньої енергії і ентропії газу в результаті цих двох процесів.
3.50Термоізольована посудина поділена перегородкою на дві частини так, що об’єм однієї з них в п=2,0 рази більше від
об'єму іншої. У меншій частині міститься ν1 =0,30 молі азоту, а в більшій частині ν2 =0,70 моля кисню. Температура газів
однакова. У перегородці відкрили отвір, і гази перемішалися. Знайти відповідний приріст ентропії системи, вважаючи гази ідеальними.
3.51 Кусок міді масою т1=300 г при температурі t1 =97 °С помістили в калориметр, де знаходиться вода маси m2=100 г при температурі t2 =7°С. Знайти приріст ентропії системи після
вирівнювання температур. Теплоємністю калориметра знехтувати.
3.52 Два однакові термоізольовані посудини, з’єднані трубкою з краном, містять по одному молю одного і того самого ідеального газу. Температура газу в одній посудині Т1, в іншій Т2. Молярна теплоємність газу при постійному об'ємі дорівнює CV . Після відкриття крану газ перейшов у новий стан
рівноваги. Знайти S — приріст ентропії газу. Показати, що S
> 0.
83
ВІДПОВІДІ ДО ЗАДАЧ ДЛЯ САМОСТІЙНОГО
РОЗВ’ЯЗАННЯ
1.1 |
F = |
l |
|
|
pS = 32,3 кН. |
|
|||||||
h |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
1.2 |
|
|
|
|
|
|
|
æ |
m |
ö |
|
|
|
p = p |
0 |
ç1- |
|
÷ = 2,67 |
кПа. |
||||||||
|
|||||||||||||
|
|
|
|
|
|
ç |
rV |
÷ |
|
|
|||
|
|
|
|
|
|
|
|
è |
ø |
|
|
||
1.3 |
|
m = rV (1- p / p0 )=0,05 кг, тут ρ = 1000 кг/м3 – густина води. |
|||||||||||
1.4 |
p = 2 |
(p0 + rgDh1 )l |
- rgDh = 47,2 кПа. |
||||||||||
|
|
||||||||||||
|
|
|
|
|
|
2l + Dh2 - Dh1 |
1 |
||||||
|
|
|
|
|
|
|
|||||||
1.5 |
t |
2 |
= |
p2 |
(t +T )-T = 473 °С. (T = 273 °С). |
||||||||
|
|||||||||||||
|
|
|
|
|
|
|
1 |
0 |
0 |
|
0 |
||
|
|
|
|
|
p1 |
|
|
|
|
||||
1.6 350 К.
1.7 m = rV T1 -T2 = 66,5 г ( ρ - густина води).
T1
1.8V = (l2 -l1 )ST1 - l1S =106 см3. T2 -T1
1.9h = 4,5 см.
1.10m = mpV /(RT )= 0,212 кг.
1.11V = νRT / p = 3,32 м3.
1.12p = mRT /(mV )=1,16 МПа.
1.13T = pmV /(mR)= 275 К.
1.14r = mp /(RT )= 2,56×10−2 кг/м3.
1.15642 Н.
1.16 V = |
Dm × R ×T1 ×T2 |
= 67,5 м3. |
||||||
|
|
|||||||
|
(T -T ) × p |
0 |
×m |
|
||||
|
2 |
1 |
|
|
|
|
||
1.17 F = (m |
2 |
- m )g |
pV |
|
=10,9 кН. |
|||
|
||||||||
|
|
1 |
RT |
|
||||
|
|
|
|
|
||||
84
1.18 |
m = |
mV |
|
Dp = 8,3 |
г. |
|
|
|
|
|
|
|
|
|
|||||
RT |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
æ |
|
p1 |
|
|
ö |
|
|
|
|
|
|
||||
1.19 |
|
|
|
V ç |
p2 ÷ |
|
|
|
кг ( k = 7 / 8). |
||||||||||
Dm = m |
R çk |
|
- |
|
|
÷ |
= 6,16 |
||||||||||||
T |
T |
|
|||||||||||||||||
|
|
|
|
è |
|
1 |
|
|
2 |
ø |
|
|
|
|
|
|
|||
1.20 V = (m / m + m / m |
|
) |
RT |
= 6,42 м3. |
|||||||||||||||
|
|
||||||||||||||||||
|
|
1 |
1 |
|
2 |
|
2 |
|
|
|
p |
|
|
|
|
|
|||
1.21 |
p '= |
p1V1 |
|
= 0,76 МПа; p |
2 |
'= |
p2V2 |
=1,12 МПа; |
|||||||||||
|
|
||||||||||||||||||
|
1 |
V1 |
+V2 |
|
|
|
|
|
|
|
|
|
V1 +V2 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
p = p1'+ p2 '=1,88 МПа.
|
|
|
|
æ |
|
|
|
m2 |
ö |
RT |
|
|
|
|
|||||||
1.22 |
|
p = |
|
ç m1 |
+ |
|
÷ |
=175 кПа. |
|||||||||||||
|
|
ç m |
|
m |
2 |
÷ |
V |
||||||||||||||
|
|
|
|
è 1 |
|
|
|
|
|
ø |
|
|
|
|
|
|
|
||||
1.23 |
r = |
|
|
|
9m1m2 |
|
|
|
p |
|
= |
|
3 |
|
|||||||
|
|
|
|
|
|
|
|
0,481 кг/м |
. |
||||||||||||
8m + m |
2 |
|
RT |
||||||||||||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
1.24 |
|
p1 = |
|
w1m2 p |
|
|
|
|
0,18 МПа; |
||||||||||||
|
(1- w )m + w m |
2 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
1 |
|
1 |
|
1 |
|
|
|
||||||
p2 = |
(1- w1)m1 p |
|
|
|
= 0,82 МПа. |
|
|||||||||||||||
(1- w )m + w m |
2 |
|
|
||||||||||||||||||
|
|
|
|
1 |
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|||||
1.25 |
|
m = |
|
|
|
w1 + w2 |
|
|
|
= 28,9×10−3 кг/моль. |
|||||||||||
|
|
|
|
|
|
/ m |
|
||||||||||||||
|
|
|
|
|
w / m + w |
|
2 |
|
|
|
|||||||||||
|
|
|
|
1 |
1 |
|
|
|
2 |
|
|
|
|
|
|||||||
1.26 |
m = |
|
|
|
|
|
|
|
|
pV |
|
|
|
|
|
= 6,87 г; m1 = w1m = 4,81 г; |
|||||
|
|
éw |
|
|
|
1- w |
ù |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
êm1 |
+ |
|
|
|
|
|
|
1 |
|
úRT |
|
|||||
|
|
|
|
|
|
|
|
|
m |
2 |
|
|
|
||||||||
|
|
|
|
ë 1 |
|
|
|
|
|
|
|
|
û |
|
|
|
|
||||
m2 = (1- w1 )= 2,06 г. |
|
|
|
|
|||||||||||||||||
1.27 |
T = |
|
|
|
|
|
|
|
pV |
|
|
|
|
|
= 259 К. |
||||||
æ |
|
|
|
|
|
|
|
|
|
ö |
|
|
|||||||||
|
|
|
|
ç w1 |
+ |
|
1- w1 |
÷ |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
ç m |
|
|
|
|
m |
2 |
|
|
÷mR |
|
|||||||
|
|
|
|
è 1 |
|
|
|
|
|
|
|
|
ø |
|
|
|
|
||||
1.28ν = 0,788 моль; n1 = 0,068 моль; n2 = 0,720 моль.
1.29m = rVDp / p0 =30 г, де p0 - нормальний атмосферний тиск.
1.30p = ( p1T2 / T1 - Dp) / 2 =10кПа (0,10атм).
85
1.31 |
m1 / m2 = (1- a / m2) /(a / m1 -1) =0,50, де a = mRT/p. |
||||||||||||||||||||
1.32 |
r = |
|
|
p0 (m1 + m2 ) |
|
|
|
=15 г/л. |
|
||||||||||||
RT (m /m + m /m |
2 |
) |
|
|
|||||||||||||||||
1.33 a) |
|
|
|
1 |
|
1 |
|
2 |
|
|
|
|
|
|
|
|
|||||
p = (n1 + n2 + n3 )RT /V =2,0 атм; |
|
||||||||||||||||||||
б) m = (n1m1 + n2m2 + n3m3) /(n1 + n2 + n3) =36,7 г/моль. |
|
||||||||||||||||||||
|
|
æ |
|
|
m2 |
ö |
RT |
|
|
|
|
5 |
|
|
|
|
|||||
1.34 |
|
|
ç m1 |
|
÷ |
|
|
|
|
Па; |
|
||||||||||
p = ç |
|
+ |
|
|
|
÷ |
|
= 3,44×10 |
|
|
|||||||||||
m |
m |
|
|
V |
|
|
|||||||||||||||
|
|
è 1 |
|
|
2 |
ø |
|
|
|
|
|
|
|
|
|
|
|
||||
m = |
|
m1 + m2 |
|
|
|
|
= 5,25×10 |
−3 кг/моль; r = |
m1 + m2 |
|
= 0,75 кг/м3. |
||||||||||
m / m + m / m |
2 |
|
V |
||||||||||||||||||
|
1 |
1 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
1.35T = T0 (h-1/ h) /(h¢ -1/ h¢) » 420 К.
1.36p = p0e−Ct /V .
1.37t = VC ln h =1,0 хв.
1.38DT = (mg + p0DS )l / R = 0,9 К
1.39а) Tmax = 23 (p0 / R)
 p0
p0  3a ; б) Tmax = epb0R .
3a ; б) Tmax = epb0R .
1.40dTdh = mRg = 33 мК/м.
1.41dT = - mg(n -1). dh nR
1.42а) h = RTmg = 8,0 км; б) h » hmRTg = 0,08 км.
1.43m = (1- e−μgh / RT )p0S g .
g .
∞∞
1.44 hC = òhrdh òrdh = RT (mg) .
(mg) .
00
1.45а) p = p0 (1- ah)n , h < 1a ; б) p = p0 /(1+ ah)n , де n = aRTmg0 .
86

2.11) 3,12 кДж/(кг·К), 5,19 кДж/(кг·К); 2) 10,4 кДж/(кг·К), 14,6 кДж/(кг·К); 3) 567 Дж/(кг·К), 756 Дж/(кг·К).
2.20,032 кг/моль, 650 Дж/(кг·К), 910 Дж/(кг·К).
2.3715 Дж/(кг·К); 1,01 кДж/(кг·К).
2.44,53 кДж/(кг·К).
2.55 981 Дж/(кг·К).
2.66 526 Дж/(кг·К).
2.7417 Дж/(кг·К).
2.8204 Дж/(кг·К).
2.91,51.
2.101,50.
2.111,42.
2.121,50.
2.13При постійному тиску.
2.141,33.
2.15166 Дж.
2.16400 Дж.
2.176,62 кДж.
2.18454 К.
2.19416 Дж.
2.20T2 = T1nγ−1 = 754 К; A = mμ γR−1(T2 − T1)= 674 Дж.
2.211,81 кДж.
2.221) 556 кДж; 2) 556 кДж; 3) 0.
2.231) 5МДж; 2) 0; 3)5 МДж.
2.2462,5 Дж.
2.25390 К; 520 кПа.
2.261) 0,4 МДж; 2) 160 кДж; 3) 560 кДж.
2.276 кДж; 15 кДж.
2.281) 520 Дж; 2) 208 Дж; 3) 312 Дж.
2.291) 0,6, 0,4; 2) 0,71, 0,29; 3) 0,75, 0,25.
2.301 кДж.
2.311) 0; 2) 11,6 кДж; 3) 11,6 кДж.
2.3220,8 кДж; 19,2 кДж.
87
2.33 A = Q = 1,28 кДж.
2.34 A = Q = 2,06 кДж.
2.35 V2 /V1 = eQ /(νRT ) = 2,23 ( ν - кількість речовини кисню).
2.36 191 Дж.
2.37 1) 21 кДж; 2) 6 кДж.
2.38 m = μ(γ −(1()γn−γ−)1 U) = 67,2 г.
RT1 n 1 −1
2.39− 3,8 МДж.
2.40157 К; 8,5 кДж.
2.411) T = (γ −1)μ U /(mR)= 616 К;
2) p |
2 |
= p (T −T )γ(γ−1) =11,4 МПа; де T = T − T . |
||||
|
1 |
2 |
1 |
1 |
2 |
|
2.422,52 МПа.
2.4317,6.
2.441) U = 11,3 кДж; 2) Q = 17,1 кДж; 3) A = 5,8 кДж.
2.451) -41,6 кДж; 2) -41,6 кДж; 3) 0.
2.46Q = U = 7,5 кДж.
2.47U = pV /(γ −1)=10 МДж.
2.48T = 12 μυ2 (γ −1)/ R .
2.49T = T1T2 (p1V1 + p2V2 ) (p1V1T2 + p2V2T1 );
(p1V1T2 + p2V2T1 );
p = (p1V1 + p2V2 ) (V1 +V2 ).
(V1 +V2 ).
2.50 |
U = − p0V T |
/T0 (γ −1)= −0,25 кДж; Q'= − U . |
2.51 |
Q = Aγ /(γ −1) |
= 7 Дж. |
2.52 |
A = R T = 0,60 кДж; U = Q − R T =1,00 кДж; |
|
γ = Q (Q − R T )=1,6.
(Q − R T )=1,6.
2.53Q = νRT0 (1−1/ η)= 2,5 кДж.
2.54γ = ν1γ1((γ2 −1))+ ν2γ(2 (γ1 −)1) =1,33 . ν1 γ2 −1 + ν2 γ1 −1
2.55cV = 0,42Дж/(г.К), cp = 0,65 Дж/(г.К).
2.56A′ = RT(n −1− ln n).
88
2.57A'= p0V0 ln[(η +1)2 /(4η)] .
2.58Див. рис. 1, де V- ізохорний процес; р- ізобарний; T- ізотермічний; S - адіабатичний.
p |
T |
S |
V |
T |
|
||||
|
|
V |
|
p |
|
|
|
|
|
|
|
p |
|
V |
|
|
|
S |
|
0 |
|
|
|
|
|
T |
0 |
T |
|
|
|
Рисунок 1 |
|
|
2.59 а) T = T0η(γ−1)/ γ = 560 К;
б) A′ = RT0 (η(γ−1) / γ −1) (γ −1)= 1,6 кДж.
(γ −1)= 1,6 кДж.
2.60При адіабатичному стисканні більше в n = (ηγ−1 −1) (γ −1)ln η = 1,4 рази.
(γ −1)ln η = 1,4 рази.
2.61T = T0 [(η +1)2  4η](γ−1)/ 2 .
4η](γ−1)/ 2 .
2.62Q = R T (2 − γ) (γ −1).
(γ −1).
2.63Cn = R(n − γ) (n −1)(γ −1); Cn < 0 при 1< n < γ .
(n −1)(γ −1); Cn < 0 при 1< n < γ .
2.64C = R(n − γ) (n −1)(γ −1)= −4,2 Дж/(К.моль), де n = ln α
(n −1)(γ −1)= −4,2 Дж/(К.моль), де n = ln α ln β.
ln β.
2.65а) Q = R(n − γ) T 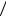 (n −1)(γ −1)= 0,11 кДж;
(n −1)(γ −1)= 0,11 кДж;
б) A = − R T (n −1)= 0,43 кДж.
(n −1)= 0,43 кДж.
2.66 а) C = − R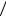 (γ −1); б) TV (γ−1)/ 2 = const ; в) A = 2RT0 (1− η(γ−1)/ 2 )
(γ −1); б) TV (γ−1)/ 2 = const ; в) A = 2RT0 (1− η(γ−1)/ 2 ) (γ −1).
(γ −1).
2.67 а) A = (1− α)R T ; б) C = R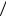 (γ −1)+ R(1− α); C < 0 при α > γ /(γ −1).
(γ −1)+ R(1− α); C < 0 при α > γ /(γ −1).
2.68 а) A = U (γ −1)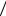 α ; Q = U[1+ (γ −1)/ α]; б) C = R
α ; Q = U[1+ (γ −1)/ α]; б) C = R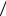 (γ −1)+ R
(γ −1)+ R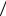 α .
α .
89

2.69а) C = Cp + RT0 / aV ; б) Q = aCp (V2 -V1 )+ RT0 ln(V2 /V1 ).
2.70а) Ve−αT / R = const ; б) TeR / βV = const ; в) V − aT = const .
2.71а) A = a ln h - RT0 (h-1)/(g -1); б) pV γeα(γ−1)/ pV = const .
3.1 0,193. |
|
|
|
|
|
|
|
|
|
|
|
||||
3.2 |
400 Дж. |
|
|
|
|
|
|
|
|
|
|||||
3.3 |
300 К; 500 К; 1000 К; 605 К; 8,55%. |
|
|||||||||||||
3.4 |
1) 7,61 МДж; 2) 7,21 МДж; 3) 0,4 МДж; 4) 5,3%. |
||||||||||||||
3.5 |
T = T = T |
|
p2 |
|
= 600 К; |
|
|
||||||||
|
p |
|
|
||||||||||||
|
2 |
|
3 |
|
1 |
|
|
|
|
|
|||||
|
|
|
|
|
p2 |
|
|
|
1 |
|
|
|
|
|
|
|
|
T ln |
|
- (T -T ) |
|
|
|||||||||
|
|
|
|
|
|
||||||||||
|
2 |
|
|
p1 |
|
|
|
2 |
|
1 |
|
|
|
||
h = |
|
|
|
|
|
|
|
|
|
= 0,099 = 9,9% . |
|
||||
T ln |
|
p2 |
+ |
i |
(T -T ) |
|
|||||||||
|
|
|
|
||||||||||||
|
2 |
|
p |
2 |
2 |
1 |
|
|
|
||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
3.6 |
1) T = 600 К; T =120 К; V =1 м3; V = 0,09 м3; |
||||||||||||||
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
2 |
3 |
|
p3 = 5,56 МПа; 2) 2 МДж; 3) 1 МДж; 4) 1 МДж; 5) 50%.
3.70,11.
3.81,88.
3.928 кДж.
3.100,404; 59,6 Дж.
3.110,25.
3.1214%; 1,16 разів.
3.1310,9%.
3.144 Дж.
3.150,74 м3.
3.16T = m1T1 + m2T2 = 323 К; m1 + m2
æ |
T |
|
T |
ö |
|
|
||
ç |
+ m2 ln |
÷ |
= 0,3 |
кДж/К (с- питома теплоємність |
||||
T |
T |
|
||||||
DS = cçm1 ln |
|
÷ |
||||||
è |
1 |
|
|
2 |
ø |
|
|
|
води).
3.17 7,2 Дж/К.
90
