
- •Оглавление:
- •Пункт 1. Электронные термы двухатомной молекулы.
- •П.2 Классификация атомных термов.
- •П.3 Пересечение электронных термов.
- •П.4 Сопоставление молекулярных термов с атомными.
- •П.5 Валентность.
- •П.6Взаимодействие атомов на далеких расстояниях.
- •П. 7 Вращение и колебания молекул.
- •Список использованной литературы:
Московский Государственный Институт Электронной Техники (ТУ)
Курсовая работа по Квантовой Теории
Теория двухатомных молекул.
Оглавление:
Пункт 1. Электронные термы двухатомной молекулы. 4
П.2 Классификация атомных термов. 6
П.3 Пересечение электронных термов. 7
П.4 Сопоставление молекулярных термов с атомными. 8
П.5 Валентность. 10
П.6 Взаимодействие атомов на далеких расстояниях. 13
П. 7 Вращение и колебания молекул. 15
Список использованной литературы: 21
Простейшей двухатомной молекулой является молекула водорода, обладающая двумя эквивалентными состояниями, отличающимися друг от друга перестановкой электронов. Механизм возникновения химической связи аналогичен рассмотренному для иона водорода с той только разницей, что запрет Паули требует нахождения электронов в различных квантовомеханических состояниях. Из-за этого связанное состояние молекулы возникает только в случае противоположно направленных спинов электронов. Механизм возникновения ковалентной связи в разнообразных химических соединениях аналогичен.
Оптические спектры молекул более богаты, чем атомные, что с одной стороны связано с меньшей симметрией системы и с появлением возможности новых форм движения (колебаний и вращений ядер) с другой. Суммарная энергия молекулы складывается из трех существенно различающихся по порядку величины составляющих: энергия электронной оболочки (характерные разности между энергиями стационарных состояний соответствуют оптическому или ультрафиолетовому излучению), энергия колебания ядер (соответствует инфракрасной части спектра) и энергия вращения молекулы как целого (радиочастотный диапозон). В результате вместо характерных для излучения атомов линейчатых спектров молекулы дают полосатые спектры, состоящие из большого числа близкорасположенных линий.
Квантовомеханические расчеты двухатомных молекул оказываются существенно более трудоемкими, чем расчеты для атомов и за исключением небольшого числа простейших химических соединений пока носят уникальный характер.
Пункт 1. Электронные термы двухатомной молекулы.
В теории молекул основною роль играет тот факт, что масса ядер атомов очень велики по сравнению с массой электронов. Благодаря такой разнице в массах скорости движения ядер в молекуле малы по сравнению со скоростями электронов. Это дает возможность рассматривать электронное движение при неподвижных ядрах расположенных на заданных расстояниях друг от друга. Определяю уровни энергии Un такой системы, мы найдем, как говорят, электронные термы молекулы. В противоположность атомам, где электронные уровни представляли собой определенные числа, здесь электронные термы являются не числами, а функциями от параметров – расстояний между ядрами в молекуле. В энергию Un включается также электростатическая энергия взаимодействия ядер друг с другом, так что Un представляет собой полную энергию молекул при заданном расположении неподвижных ядер.
Электронные термы двуатомной молекулы являются функциями всего одного параметра – расстояния r между ядрами.
В теории молекул широко используются приближенные способы расчетов. Гамильтониан двухатомной молекулы имеет вид:
 (1)
(1)
Здесь M1 и М2 - массы ядер. m – Масса электронов, rk – координаты электронов, Ri – координаты ядер. Потенциальная энергия U(rk , Ri ) включает взаимодействие электронов с ядрами, электронов между собой и ядер друг с другом. Суммирование по к ведется по всем электронам молекул. В теории молекул пользуются адиабатическим приближением.
Волновая функция систем представляется в виде:
мол = an (Ri ) (rk,Ri).
Напишем уравнения для функций альфа и пси:
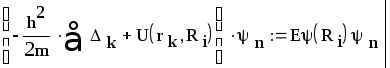 (2)
(2)
 (3)
(3)
Уравнение (2) описывает движение электронов при неподвижных ядрах. Величина Еn (Ri) определяет уровни энергии системы при неподвижных ядрах, находящихся на фиксированном расстоянии друг от друга. Энергию Еn при заданном расстоянии между ядрами называют электронным термом.
Уравнение Шредингера (3) описывает движение ядер. Входящая в него величина Еn (Ri) имеет смысл потенциальной энергии ядер. Из уравнения (3) мы видим, что полная энергия ядер Е зависит от состояния электронной части системы, от электронного терма.
