
химия + методичка / kontr_z
..pdf
120. Какие силы межмолекулярного взаимодействия называют ориентационными, индукционными и дисперсионными? Когда возникают эти силы и какова их природа?
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ (термохимические расчёты)
При решении задач этого раздела смотреть таблицу 2.
|
|
|
|
|
|
Таблица 2. |
|
|
Стандартные теплоты (энтальпии) |
образования |
H0298 |
||||
некоторых веществ. |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Вещество |
Состояние |
H0298, кДж/моль |
Вещество |
Состояние |
H0298, кДж/моль |
|
|
C2H2 |
Г |
+226,75 |
CO |
Г |
|
-110,52 |
|
CS2 |
Г |
+115,28 |
CH3OH |
Г |
|
-201,17 |
|
NO |
Г |
+90,37 |
C2H5OH |
Г |
|
-235,31 |
|
C6H6 |
Г |
+82,93 |
H2O |
Г |
|
-241,83 |
|
C2H4 |
Г |
+52,28 |
H2O |
Ж |
|
-285,84 |
|
H2S |
Г |
-20,15 |
NH4Cl |
К |
|
-315,39 |
|
NH3 |
Г |
-46,19 |
CO2 |
Г |
|
-393,51 |
|
CH4 |
Г |
-74,85 |
Fe2O3 |
К |
|
-822,10 |
|
C2H6 |
Г |
-84,67 |
Ca(OH)2 |
К |
|
-986,50 |
|
HCl |
Г |
-92,31 |
Al2O3 |
К |
|
-1669,80 |
|
N2O |
Г |
-33,50 |
SiO2 |
К |
|
-910,90 |
|
SO2 |
Г |
-296,90 |
MgO |
К |
|
-601,80 |
|
|
|
|
ZnO |
К |
|
-350,60 |
Науку о взаимных превращениях различных видов энергии называют термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного течения различных процессов в данных условиях.
При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией. Реакции, которые сопровождаются выделением теплоты, называют экзотермическими, а те, которые сопровождаются поглощением теплоты – эндотермическими. Теплоты реакций являются, таким образом, мерой изменения свойств системы, и знание их может иметь
31

большое значение при определении условий протекания тех или иных реакций.
При любом процессе соблюдается закон сохранения энергии как проявление более общего закона природы – закона сохранения материи. Теплота Q, поглощенная системой, идет на изменение ее внутренней энергии и на совершение работы А: 

Внутренняя энергия системы – это общий ее запас, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов, внутриядерную энергию и т.д. Внутренняя энергия – это полная энергия системы без потенциальной энергии, обусловленной положением системы в пространстве, и без кинетической энергии системы как целого. Абсолютное значение внутренней энергии веществ неизвестно, так как нельзя привести систему в состояние, лишенное энергии. Внутренняя энергия, как и любой вид энергии, является ф у н к ц и е й с о с т о я н и я , т.е. ее изменение однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода, по которому
протекает |
процесс |
, |
где |
- изменение |
внутренней |
энергии системы при переходе от начального состояния |
в конечное |
||||
. Если |
,то |
. Если |
|
. |
|
Теплота и работа функциями состояния не являются, ибо они служат формами передачи энергии и связаны с процессом, а не с состоянием системы. При химических реакциях А – это работа против
внешнего |
давления, |
т.е. |
в |
первом |
приближении |
|
|
|
. |
|
|
|
|
|
Так как большинство химических реакций проходит при |
||||
постоянном давлении, то для |
изобарно-изотермического процесса |
|||
|
теплота: |
|
|
|
или: |
; |
|
|
|
|
|
|
|
|
или: |
|
|
|
|
Сумму U+pV – обозначим через H, тогда |
|
. |
||
Величину Н называют энтальпией. Таким образом, теплота |
||||
при |
приобретает свойство функции состояния и |
|||
не зависит от пути, по которому протекает процесс. Отсюда теплота
реакции в изобарно-изотермическом процессе |
равна изменению |
32 |
|
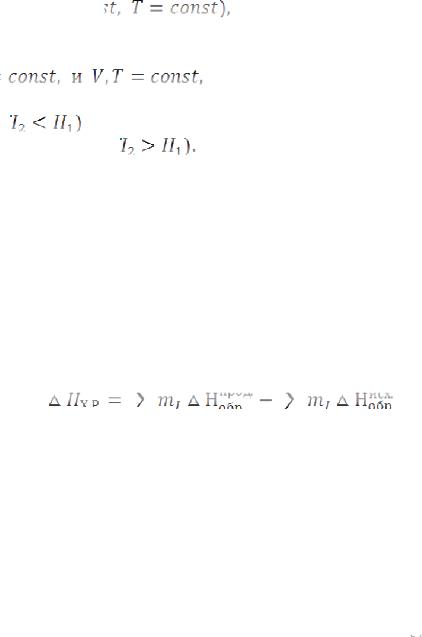
энтальпии системы |
(если единственным видом работы является |
|
работа расширения): |
|
. |
Энтальпия, как и внутренняя энергия, является функцией |
||
состояния; ее изменение |
определяется только начальным и |
|
конечным состояниями системы и не зависит от пути перехода. Нетрудно видеть, что теплота реакции в изохорно-изотермическом
процессе |
|
при котором |
, |
равна |
изменению внутренней энергии системы: |
|
|
||
Теплоты |
химических |
процессов, |
протекающих |
|
|
называют тепловыми эффектами. |
|||
При экзотермических реакциях энтальпия системы уменьшается |
||||
и |
, а при эндотермических – энтальпия системы уве- |
|||
личивается и |
В |
дальнейшем тепловые |
эффекты |
|
всюду выражаются через . |
|
|
|
|
Термохимические расчеты основаны на законе Гесса (1840): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Часто в термохимических расчетах применяют следствие из
закона Гесса: тепловой эффект реакции |
равен сумме теплот |
|
образования |
продуктов реакции за вычетом суммы теплот |
|
образования |
исходных веществ с учетом |
коэффициентов перед |
формулами этих веществ в уравнении реакции.
Пример 1. При взаимодействии кристаллов хлорида фосфора с парами воды образуется жидкий и хлорид водорода. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите
термохимическое уравнение этой реакции.
Решение. Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также численное значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении 

 , равные изменению энтальпии системы
, равные изменению энтальпии системы 


 Значение
Значение 

 приводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г – газообразное, ж – жидкое, к – кристаллическое. Эти символы опускаются, если агрегатное состояние вещества очевидно.
приводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г – газообразное, ж – жидкое, к – кристаллическое. Эти символы опускаются, если агрегатное состояние вещества очевидно.
33
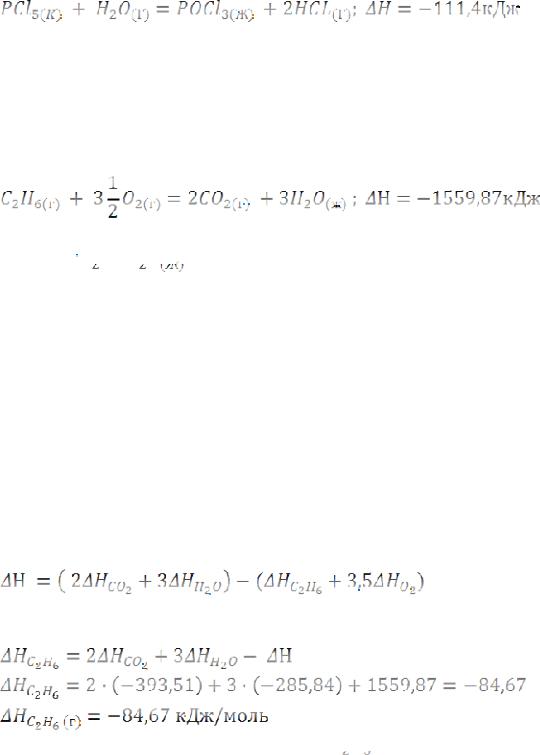
Если в результате реакции выделяется теплота, то 






 .
.
Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции:
.
Пример 2. Реакция горения этана выражается термохимическим уравнением:
Вычислите теплоту образования этана, если известны теплоты образования 



















 (см.табл.2).
(см.табл.2).
Решение. Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моля этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях. Обычно теплоты образования относят к стандартному состоянию, т.е. 25°С (298 К) и 1,013∙105 Па, и обозначают через
H0298. Так как тепловой эффект с температурой изменяется незначительно, то здесь и в дальнейшем индексы опускаются и тепловой эффект обозначается через 

 .
.
На основании следствия из закона Гесса:
Учитывая, что теплоты образования простых веществ условно приняты равными нулю:
Пример 3. При образовании 10,2 г 







 из простых веществ выделяется 166,98 кДж теплоты. Рассчитать стандартную энтальпию
из простых веществ выделяется 166,98 кДж теплоты. Рассчитать стандартную энтальпию
34

образования оксида алюминия. Написать термохимическое уравнение реакции образования 









Решение. Составим уравнение реакции таким образом, чтобы в результате получился 1 моль 







 :
:
Находим количество теплоты, которое выделяется при образовании 1 моля 






 т.е. 102 г, из пропорции:
т.е. 102 г, из пропорции:
Следовательно, |
кДж/моль, (знак “-”, т.к. те- |
плота выделяется). Термохимическое уравнение:


























































 . Его можно записать и так:
. Его можно записать и так: 































































Пример 4. Вычислить стандартную теплоту образования жидкого бензола по уравнению:



















 ,
,
используя значения стандартных энтальпий образования веществ. Решение.
Откуда: |
|
Значения |
находим в табл. 2 и подставляем их в |
расчетное уравнение. |
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
121. Газообразный этиловый спирт |
можно получить |
|
при взаимодействии этилена |
и водяных |
паров. Напишите |
|
35 |
|

термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
Ответ: -45,76 кДж.
122. При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л 



 в пересчете на нормальные условия?
в пересчете на нормальные условия?
Ответ: -452,37 кДж.
123. Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена 





 , если продуктами сгорания являются диоксид
, если продуктами сгорания являются диоксид
углерода и пары воды?
Ответ:-9248,8кДж.
124. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования 






 .
.
Ответ: +49,03 кДж/моль.
125.Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия?
Ответ:-78,97 кДж.
126.Напишите термохимическое уравнение реакции между 


 и водородом, в результате которой образуются
и водородом, в результате которой образуются 



 и
и 




 . Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия?
. Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия?
Ответ:-618,48 кДж.
127.При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод 



 . Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
Ответ: +65,43 кДж.
128.Реакция горения метилового спирта выражается термохимическим уравнением
36
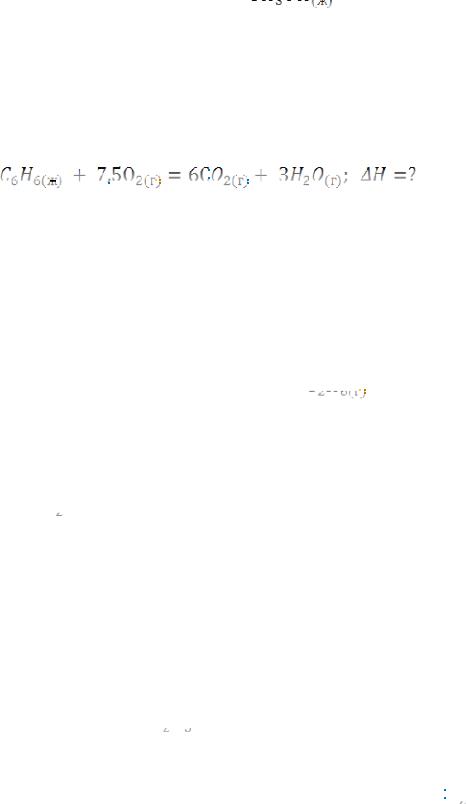
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования 














 равна +37,4 кДж/моль.
равна +37,4 кДж/моль.
Ответ:-927,79 кДж.
129. Реакция горения бензола выражается термохимическим уравнением:
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования бензола равна +33,9 кДж/моль.
Ответ: -3052,65 кДж.
130. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моля этана 










 , в результате которой
, в результате которой
образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в перерасчете на нормальные условия?
Ответ:-63742,86 кДж.
131. При сжигании серы выделилось 73,48 кДж тепла и получилось 16г 





 . Вычислить стандартную энтальпию образования диок-
. Вычислить стандартную энтальпию образования диок-
сида серы SO2.
Ответ: -293,9 кДж/моль.
132. При соединении 2,1 г железа с серой выделилось 3,77 кДж. Рассчитать стандартную энтальпию образования сульфида железа





 .
.
Ответ: -100,5 кДж/моль.
133. При соединении 9 г алюминия с кислородом выделяется
279,15 кДж теплоты. Определить стандартную энтальпию образования оксида алюминия 







 .
.
Ответ: -1675 кДж/моль.
134. При разложении 0,5 моля СО2 поглощается 196,75 кДж теплоты. Определить стандартную энтальпию образования 




 .
.
Ответ: -393,5 кДж/моль.
37
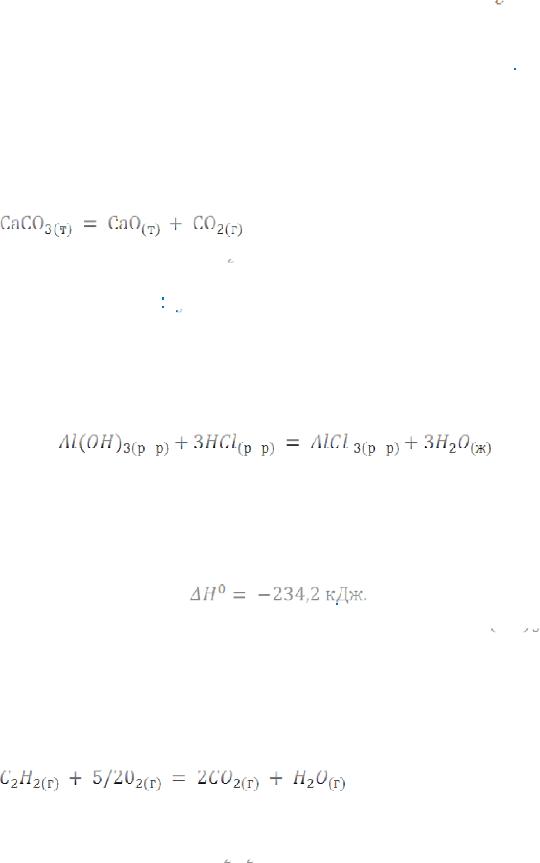
135. При сжигании 3 г магния выделилось 75,2 кДж тепла. Вычислить стандартную энтальпию образования оксида магния 





 .
.
Ответ: -601,6 кДж/моль.
136. При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа 





 .
.
Ответ: -100,26 кДж.
137.Реакция выражается уравнением
При получении 134,4 л 



 , измеренного при стандартных условиях, поглощается 1205,4 кДж теплоты. Вычислить тепловой эффект реакции разложения
, измеренного при стандартных условиях, поглощается 1205,4 кДж теплоты. Вычислить тепловой эффект реакции разложения 







 .
.
Ответ: +201 кДж/моль.
138. Реакция взаимодействия гидроксида алюминия с соляной кислотой идет по уравнению
;
Сколько тепла выделится, если для реакции взято 7,8г 











 ? Ответ: -23,42 кДж.
? Ответ: -23,42 кДж.
139.По уравнению реакции горения ацетилена
истандартным энтальпиям образования участвующих в реакциях веществ вычислить тепловой эффект реакции и найти, сколько теплоты
выделяется при сгорании 1 м3 






 , принимая условия нормальными.
, принимая условия нормальными.
38

Ответ: -1255,6 кДж; -56053 кДж/м3:
140. Стандартная энтальпия образования треххлористого фосфора равна -317,8 кДж. Сколько теплоты выделится при образовании
96 г 




 ?
?
Ответ: - 221,9 кДж.
141. При образовании 39,6 г 







 выделяется 648,2 кДж тепла. Вычислить стандартную энтальпию образования
выделяется 648,2 кДж тепла. Вычислить стандартную энтальпию образования 







 .
.
Ответ:-1669 кДж/моль.
142. При образовании 8,10 г двухлористой меди выделяется 13,4 кДж тепла. Вычислить стандартную энтальпию образования двухлористой меди 







 .
.
Ответ: -223,3 кДж/моль.
143. Реакция растворения оксида меди (II) в соляной кислоте идет по уравнению:
Сколько тепла выделится при растворении 100 г 





 ?
?
Ответ:-79,91 кДж.
144. Горение метана идет по уравнению
Вычислить тепловой эффект реакции по стандартным энтальпиям образования участвующих в ней веществ и найти, сколько теплоты выделится при сжигании 1 м3 метана.
Ответ: -802,2кДж; -35812,5 кДж/м3 .
145. Реакция горения пропана идет по уравнению
Вычислить стандартную энтальпию образования пропана. Ответ: -103,9 кДж/моль.
39
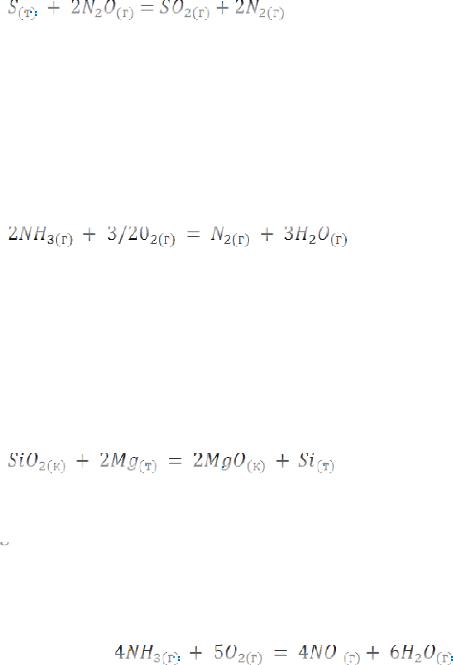
146. Горение серы в гемиоксиде азота идет по уравнению
Вычислить тепловой эффект реакции по стандартным энтальпиям образования веществ и найти, сколько теплоты выделится при сгорании 1 г серы.
Ответ: -230 кДж; -7,2 кДж.
147. Реакция окисления аммиака идет по уравнению
Вычислить тепловой эффект реакции по стандартным энтальпиям образования веществ и найти, сколько теплоты выделится при образовании 4,48 л азота, измеренного при нормальных условиях.
Ответ: -633,1 кДж; -126,6 кДж.
148. Вычислить тепловой эффект реакции
Используя значения стандартных энтальпий образования веществ, найти количество теплоты, которое выделится при взаимодействии
6г 





 .
.
Ответ: -292,7 кДж; -36,59 кДж.
149. Рассчитать тепловой эффект реакции
,
используя значения стандартных энтальпий образования веществ. От-
вет: -904,74 кДж.
150. Вычислить стандартную энтальпию образования сульфида цинка по уравнению
40
