
химия + методичка / kontr_z
..pdfЛИТЕРАТУРА
Основная
1.ГлинкаН.Л.Общаяхимия.Л.:Химия,1977-1996.
2.КоровинН.В. Общаяхимия-М.:Высшаяшкола,1998-2003.
3.ЛучинскийГ.П.Курсхимии.-М.:Высшаяшкола,1985-1994.
Дополнительная
1.ФроловВ.В. Химия.-М.:Высшаяшкола,1986-1994.
2.БесчастновА.Г. Общаяхимия.-Мн.:Вышэйшаяшкола,1977-1991.
3.Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. -М.:
Химия,1981.
4.Стругацкий М.К., Надеинский В.П. Общая химия. -М.: Высшая школа, 1972.
Перечень наглядных пособий, методических указаний и материалов к учебнымзанятиям
1.Химия. Лабораторныйпрактикум по одноименномукурсудля студентов нехимическихспециальностейдневнойформыобучения. Гомель,2008г.
2.Задачник к лабораторному практикуму по химии для студентов всех специальностейдневногоотделения.Гомель,2011г.
3.ДемонстрационнаятаблицаэлементовД.И.Менделеева.
4.Плакатыпотемамлекций.
11

КОНТРОЛЬНЫЕЗАДАНИЯ
Каждый студент выполняет вариант контрольных заданий, обозначенный двумяпоследнимицифраминомерастуденческогобилета.
ЭКВИВАЛЕНТЫ И ЭКВИВАЛЕНТНЫЕ МАССЫ ПРОСТЫХ И СЛОЖНЫХВЕЩЕСТВ.ЗАКОНЭКВИВАЛЕНТОВ.
Пример 1. Определите эквивалент (Э) и эквивалентную массу 




 азота, серыихлоравсоединениях
азота, серыихлоравсоединениях





 ,
, 




 и
и 



 .
.
Решение. Массавещества и количество вещества – понятия неидентичные. Массавыражаетсявкилограммах(граммах),аколичествовеществах–вмолях.
Эквивалент элемента (Э) – это такое количество элемента, которое соединяетсяс1 моль атомовводородаилизамещает тожеколичествоатомовводорода в химических реакциях. Масса 1 эквивалента элемента называется его эквивалентной массой (




 ). Таким образом, эквиваленты выражаются в молях, а экви-
). Таким образом, эквиваленты выражаются в молях, а экви-
валентныемассы–вг/моль.
В данных соединениях с1 моль атомовводорода соединяется1/3 моль азо-
та, 1/2 моль серы и 1 моль хлора. Отсюда |
, |
||
|
|
Исходя из молярных масс этих элементов, |
|
|
|
||
определяемихэквивалентныемассы: |
; |
||
Пример 2. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите эквивалентную массу оксида и эквивалентнуюмассуметалла.Чемуравнаатомнаямассаметалла?
Нормальные условия по Международной системе единиц (СИ): давление 1,013·


 Па (760 мм рт.ст.=1атм.),температура273 К или0°С.
Па (760 мм рт.ст.=1атм.),температура273 К или0°С.
Решение. Согласно закону эквивалентов массы (объемы) реагирующих друг с другом веществ 


 и
и 



 пропорциональны их эквивалентным массам (объемам):
пропорциональны их эквивалентным массам (объемам):
(1)
(2)
Если одно из веществ находитсяв газообразном состоянии, токак правило, егоколичествоизмеряетсявобъемныхединицах(см3, л, м3).
12

Объем, занимаемый при данных условиях молярной или эквивалентной массой газообразного вещества, называется молярным или, соответственно, эквивалентным объемом этого вещества. Молярный объем любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объем водорода 








 ,
,
молекула которого состоит из двух атомов, т.е. содержит два моля эквивалентов водорода, равен 
















 . В формуле (2) отноше-
. В формуле (2) отноше-
ние 
















 заменяем равным ему отношением
заменяем равным ему отношением 














 , где
, где 


– объем водорода, 







 – эквивалентный объем водорода:
– эквивалентный объем водорода:
(3)
Из уравнения (3) находим эквивалентную массу оксида металла









 :
:
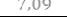





 ;
; 




















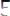


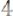
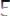


















 .
.
Согласно закону сохранения массы: 


































 (см. примеры 5, 7, стр. 11-12)
(см. примеры 5, 7, стр. 11-12)
Отсюда |
|
|
|
. |
|
Молярная |
масса |
металла определяется из соотношения |
|||
|
– эквивалентная масса, |
А – молярная масса атома |
|||
элемента, |
В – |
стехиометрическая |
валентность элемента; |
||
|
|
|
|
. Так как атомная масса в а.е.м. чис- |
|
|
|
|
|
||
ленно равна мольной (молярной) массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
Пример3. 0,01345г металла вытеснили из раствора кислоты 12мл водорода, собранного и измеренного над водой при 20°С и 762мм.рт. ст. Давление пара воды при 20°С составляет 17,5 мм. рт. ст. Найти эквивалентную массу металла.
Решение. С помощью уравнения объединённого газового закона (Клапейрона) приведём объём вытесненного водорода к нормальным условиям:
(1)
При этом необходимо учесть, что водород, собранный над водой, содержит водяной пар и что общее давление водорода и пара, равное атмосферному ( 762 мм.рт. ст. ), складывается из парциальных давлений водорода и водяного пара.
13

Откуда: 
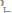







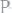



 или
или
Находим объём водорода, приведённый к нормальным услови-
ям:
Из (1): 








или |
|
(мл) |
|
Определяем эквивалентную массу металла:








 ;
;
отсюда 
























 (г/моль)
(г/моль)
Пример 4. Сколько граммов металла, эквивалентная масса которого 















 , взаимодействует с
, взаимодействует с 







 кислорода (н.у.)?
кислорода (н.у.)?
Решение. Так как молярная масса О2 (32 г/моль) при н.у. занимает объем 22,4 л, то объем эквивалентной массы кислорода 















 будет
будет 









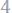






















 По закону эквива-
По закону эквива-
лентов: 

 , откуда:
, откуда: 



































Пример 5. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла 









 ).
).
Решение. При решении задачи следует иметь в виду: а) эквивалент (эквивалентная масса) гидроксида равен сумме эквивалентов (эквивалентных масс) металла и гидроксидной группы; б) эквивалент (эквивалентная масса) соли равен сумме эквивалентов (эквивалентных масс) металла и кислотного остатка. Вообще эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей.
Согласно закону эквивалентов, запишем:


 ;
;
14

Кроме того, эквиваленты (эквивалентные массы) химических соединений могут быть подсчитаны и другими способами:
Пример 6. В какой массе |
содержится столько же экви- |
||
валентов, сколько в |
? |
|
|
Решение: Эквивалентная масса |
равна 1/3 его мольной |
||
массы, т.е. |
Следовательно, в |
содер- |
|
жится |
эквивалентов. Эквивалентная масса |
|
|
равна 1/2 его мольной массы, т.е. |
Отсюда 12 эквивалентов |
||
составляют |
|
|
|
Пример 7. При окислении |
магния получено |
его |
|
оксида. Чему равна эквивалентная масса магния?
Решение. Найдем массу кислорода, вступившего в реакцию, по закону сохранения массы:
По закону эквивалентов рассчитаем эквивалентную массу магния, зная, что эквивалентная масса кислорода равна 
























 ;
;























 (г/моль).
(г/моль).
Итак, эквивалентная масса магния равна 



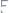












 Пример 8. В хлориде серебра содержится
Пример 8. В хлориде серебра содержится 











 серебра. Оп-
серебра. Оп-
ределить эквивалентную массу хлора, если известно, что эквивалентная масса серебра равна 











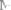








15

Решение. Процентное содержание хлора в хлорида серебра составляет: 
















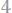




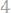




 Согласно закону эквивалентов:
Согласно закону эквивалентов:


 ;
; 

















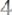

 (г/моль).
(г/моль).
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Вычислить эквивалентные массы кислоты, основания и соли в следующих реакциях нейтрализации:
а) 




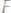










































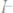




 б)
б) 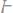



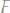

























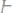

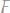







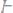




 в)
в) 




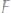

























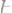













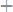







г) 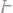



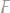
















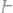














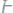














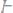





2. Простое вещество в количестве 28,5 г прореагировало с водородом с взрывом, при этом было получено 30 г нового сложного вещества. Определить эквивалентную массу элемента, соединившегося с водородом.
Ответ: 













3. При окислении 8,45 г металла образовалось 9,65 г оксида. Вычислить эквивалентные массы металла и его оксида.
Ответ: 


















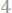















4. При восстановлении водородом 20,342 г оксида металла образовалось 4,504 г воды, эквивалентная масса которой 9,008 г/моль. Чему равны эквивалентные массы металла и его оксида?
Ответ: 



















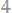


















5. 2,64 г оксида металла содержит 0,32 г кислорода. Определить эквивалентные массы металла и оксида.
Ответ: 




















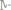








6. Окислением 1,4 г кадмия получили 1,6 г оксида. Вычислить эквивалентную массу кадмия и его оксида.
Ответ: 



























 .
.
7. Вычислить эквивалентную массу и валентность мышьяка в соединении его с серой, в котором на 5 г мышьяка приходится 5,35 г серы. Эквивалентная масса серы равна 













16

Ответ:
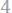

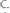













 ; 5.
; 5.
8. Сколько граммов водорода выделится при растворении в соляной кислоте 10 г металла, имеющего эквивалентную массу, равную
9.При сжигании 10 г простого вещества было получено 16,68 г оксида. Определить эквивалентную массу элемента, образовавшего оксид. Что это за элемент? (Валентность элемента равна 4).
Ответ: 


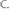














10.Вычислить эквивалентную массу элемента, зная, что содержание кислорода в оксиде составляет 

































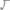



11.В одном оксиде азота содержится 











 кислорода, а в другом оксиде
кислорода, а в другом оксиде 

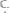


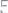






 кислорода. Вычислить эквивалентные массы азота в каждом из оксидов. Написать формулы оксидов азота.
кислорода. Вычислить эквивалентные массы азота в каждом из оксидов. Написать формулы оксидов азота.
Ответ: 





























12.Оксид металла восстановили водородом. Вычислить эквивалентную массу металла, зная навеску оксида металла и массу полученной при восстановлении воды:
а) металл – |
, |
навеска оксида – 1,51г. |
масса |
б) металл – W, |
навеска – 2,24г. |
масса |
|
в) металл – |
, |
навеска – 1,52г. |
масса |
Ответ: а) 29,75; б) 36,8; в) 17,33;
13.Олово образует два оксида, содержащих: первый 










 олова, второй
олова, второй 









 олова. Вычислить эквивалентные массы олова, исходя из состава этих оксидов. Написать формулы оксидов. Ответ:
олова. Вычислить эквивалентные массы олова, исходя из состава этих оксидов. Написать формулы оксидов. Ответ:
14.Некоторый металл образует два хлористых соединения с содержанием хлора 











 в первом хлориде и
в первом хлориде и 

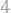







 во втором.
во втором.
Вычислить эквивалентные массы металла в каждом случае, приняв эквивалентную массу хлора равной 


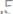











15.Оксид содержит 











 металла. Вычислить эквивалентные массы металла и его оксида.
металла. Вычислить эквивалентные массы металла и его оксида.
Ответ: 









































16.0,912 г металла вытеснили из соляной кислоты 348 мл водорода, собранного над водой и измеренного при 20°С и 750 мм.рт.ст.
17

(100 кПа). Вычислить эквивалентную массу металла. Давление пара воды составляет 




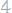



























17. Некоторый элемент образует гидрид, содержащий 









 водорода. Вычислить эквивалентную массу элемента.
водорода. Вычислить эквивалентную массу элемента.
Ответ: 

















18.Эквивалентная масса металла равна 
















 Вычислить процентное содержание металла в его оксиде.
Вычислить процентное содержание металла в его оксиде.
Ответ: 













19.Хлорид металла содержит 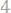
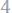









 хлора. Считая эквивалентную массу хлора равной
хлора. Считая эквивалентную массу хлора равной



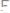










 , определить эквивалентную массу металла.
, определить эквивалентную массу металла.
Ответ: 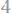

















20.Эквивалентная масса элемента составляет 
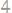
















Вычислить, сколько процентов водорода содержится в гидриде этого элемента.
Ответ: 











21. 0,327 г металла вытеснили из раствора кислоты 162 мл водорода, собранного и измеренного над водой при 25°С и 745 мм.рт.ст. (99,3 кПа). Давление пара воды при 25°С составляет 23,5 мм.рт.ст. (3,13кПа). Найти эквивалентную массу металла.
Ответ:


















22. При взаимодействии 1,25 г металла с водой выделилось 380 мл. водорода, собранного над водой и измеренного при температуре 




























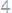






























 Найти эквивалентную
Найти эквивалентную
массу металла. Давление пара воды составляет 18,7 мм.рт.ст. (3,1кПа). Ответ: 39,4 г/моль.
23. Какое количество оксида получится при окислении: а)


































 б)1г металла
б)1г металла 
















Ответ: а) 0,7г; б) 1,347г.
24. Вычислить эквивалентную массу цинка, зная, что 0,572 г его вытеснили из кислоты 219 мл водорода, измеренного при 











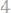





















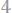








 Давление пара воды при 18°0 со-
Давление пара воды при 18°0 со-
ставляет 




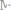

























18

25.Эквивалентная масса некоторого металла равна 9. Сколько граммов этого металла нужно взять, чтобы при растворении его в кислоте выделилась 2,24 л. водорода (при н. у.)
Ответ: 1.8г.
26.Чему равен при н.у. эквивалентный объем водорода? Вычислите эквивалентную массу металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.).
Ответ: 32















27. Оксид трехвалентного элемента содержит 47,06% кислорода. Вычислите эквивалентную и молярную массу атома этого элемента. Ответ: 




























28. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла.
Ответ: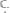








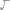

 .
.
29. Из 1,35 г оксида металла получается 3,15 с его нитрата. Вычислите эквивалентную массу этого металла.
Ответ: 


















30.Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях 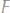

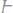




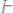






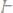

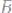





31.При разложении 1,442г. иодида некоторого 2х валентного металла на нагретой до соответствующей температуры пластинке
масса её увеличилась на 







 Определить, иодид какого металла
Определить, иодид какого металла
взят.
Ответ: иодид кадмия.
32. На восстановление 









 оксида металла потребовалось
оксида металла потребовалось
22,4 л водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы металла и его оксида.
Ответ: 



































33. На восстановление 7,95 г оксида металла требуется 2,24л водорода, измеренного при нормальных условиях, или 0,6 г углерода. Вычислить эквивалентные массы металла, оксида металла и углерода. Ответ: 




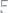















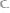































34. Сколько эквивалентных масс содержат следующие соедине-
ния: а)






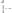




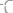



 ; б)170г
; б)170г 









 ; в)520г
; в)520г 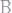










 ; г) 684, 32г Al2(SO4)3.
; г) 684, 32г Al2(SO4)3.
19

35. Для полного восстановления 1,50 г оксида металла потребовалось 478 мл водорода, измеренного при 20°С и 730 мм.рт.ст. (97,7кПа). Вычислить эквивалентную массу оксида и металла.
Ответ: 





































36.Имеется хлорид и оксид некоторого элемента, проявляющего
всвоих соединениях валентность 3 и 5. Содержание хлора в хлориде











 , кислорода в оксиде –
, кислорода в оксиде – 











 Определите элемент и установите формулы рассматриваемых веществ.
Определите элемент и установите формулы рассматриваемых веществ.
Ответ: 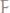







37. Эквивалентная масса некоторого металла равна 6. Вычислите процентное содержание кислорода в оксиде этого элемента.
Ответ: 










 38. В каком количестве
38. В каком количестве 











 содержится столько же эквива-
содержится столько же эквива-
лентов, сколько в 174, 96г.













 ? Ответ: 206 г.
? Ответ: 206 г.
39.При взаимодействии 0,9г 3х валентного металла с серой образовалось 2,5г сульфида. Вычислите эквивалентную массу и молярную массу атома металла.
Ответ: 9; 27;
40.7г железа вытесняют из кислоты 2,82л водорода, измеренного при н.у. Какова валентность железа в образующемся соединении?
Строение атома. Химическая связь и строение молекул.
Пример 1. Что такое квантовые числа? Какие значения они могут принимать?
Решение. Движение электрона в атоме носит вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,9-0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами),получившими название квантовых чисел (n ,l, 



 ). Квантовые числа принимают не
). Квантовые числа принимают не
любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер ( n ), форму (l) и ориентацию ( 


 ) атомной
) атомной
орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму. Формы облаков элек-
20
