
химия + методичка / kontr_z
..pdf














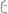













 Чему равны исходные концентрации воды и
Чему равны исходные концентрации воды и



 ?
?
Ответ: K=1; 






 0,08 моль/л; [С0]=0,02 моль/л.
0,08 моль/л; [С0]=0,02 моль/л.
197. Реакция между веществами А и В выражается уравнением:
Начальная концентрация вещества А равна 0,3 моль, вещества В равна 0,5 моль. Константа скорости реакции равна 0,8. Рассчитайте начальную скорость и скорость по истечении некоторого времени, когда концентрация вещества А уменьшилась на 











Ответ: 0,036 моль/л·мин-1; 0,0144 моль/л·мин-1; 198. Реакция идет по уравнению:
Через некоторое время после начала реакции концентрации участвующих в ней веществ стали: 








































































 Какими были концентрации исходных веществ в начальный момент?
Какими были концентрации исходных веществ в начальный момент?
Ответ: 


































 199. Реакция омыления уксусноэтилового эфира идет по урав-
199. Реакция омыления уксусноэтилового эфира идет по урав-
нению: 




































































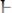




 .
.
В некоторый момент концентрации участвующих в реакции веществ составили: 


































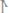

























|
Вычислить концентрации исходных ве- |
ществ в начальный момент. |
|
Ответ: |
|
200. Почему при изменении давления смещается равновесие |
|
системы |
и не смещается равновесие системы |
|
Ответ мотивируйте на основании расчета скорости |
прямой и обратной реакции в этих системах до и после увеличения давления в 2 раза. Напишите выражения для констант равновесия каждой из данных систем.
201. В двух сосудах объемом по 20 л при одинаковой температуре находятся смеси газообразных веществ А и В. В каком сосуде быстрее и во сколько раз будет протекать химическая реакция 


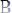


 , если в первый сосуд ввели 2 моля вещества А и 4 моля вещества В, а во второй – соответственно 6 и 4 моля веществ,
, если в первый сосуд ввели 2 моля вещества А и 4 моля вещества В, а во второй – соответственно 6 и 4 моля веществ,
61

если константа скорости реакции равна 1моль/(л·с)? Ответ подтвердите расчетом.
Ответ: в 3 раза во втором сосуде. 202. Реакция выражена уравнением
|
|
|
|
|
. |
Через некоторое время после начала реакции концентрации уча- |
|||||
ствующих |
в |
ней |
веществ |
стали |
(моль/л): |
|
|
|
; каковы |
были |
концентрации |
в начале реакции? |
|
|
|
||
Ответ: 1,45 моль/л; 0,59 моль/л. |
|
|
|||
203. Две реакции при |
протекают с одинаковой скоростью. |
||||
Температурный коэффициент первой реакции равен 2,0, второй 3,0. Как будут относиться скорости этих реакций , если первую из них проводить при 






 , а вторую – при
, а вторую – при 





 ?
?
Ответ:
204. Как изменится скорость химической реакции:




 .
.
если вместо кислорода взять такай же объём воздуха? Ответ обоснуйте.
Ответ: уменьшится в ~5 раз.
205. Вычислить, как изменится скорость химической реакции:
|
, |
если уменьшить концентрации исходных веществ в 3 раза? |
|
Ответ: в 81 раз. |
|
206. Средняя скорость реакции |
|
равна 0,02 моль/(л∙с). Каковы будут концентрации веществ А, В |
|
и С через 5с после начала реакции, |
если начальные концентрации |
веществ А и В равны соответственно |
? |
Ответ: 
















207. В 10л содержится 4моля вещества А и 5 молей вещества В. Какова будет концентрация этих веществ через 5с, если средняя скорость реакции 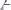

















 равна 0,04моль/(л∙с)?
равна 0,04моль/(л∙с)?
Ответ: 



















208. Как изменится скорость реакции:
62
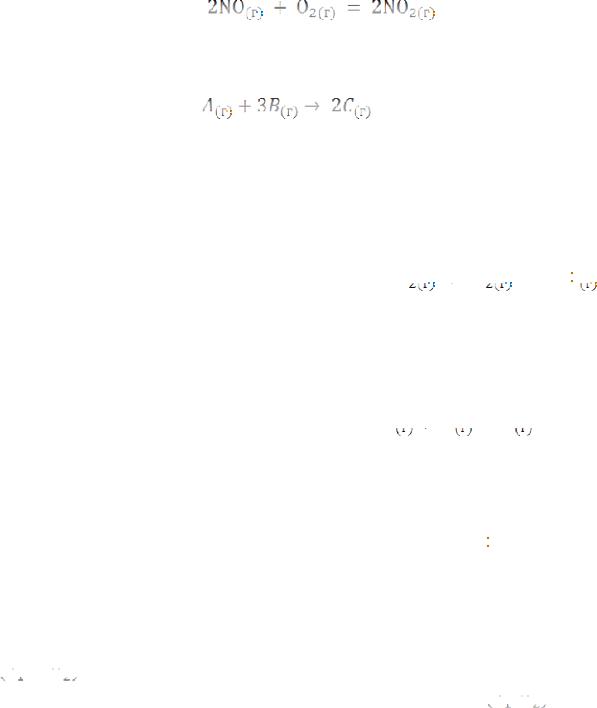
|
, |
протекающей в закрытом сосуде, если увеличить давление в 4 |
|
раза? Ответ подтвердите расчетом. |
|
Ответ: в 64 раза. |
|
209. В реакции |
начальная концентрация |
вещества А была 0,5 моль/л. Через некоторое время концентрация вещества С стала равной 0,2 моль/л, а вещества В – 0,1 моль/л. Определить начальную концентрацию вещества В, конечную концентрацию вещества А и начальную скорость реакции. Константа скорости реакции равна 1 моль/(л∙с)
Ответ: 0,4 моль/л; 0,032моль/(л∙с).
210. Реакция протекает по уравнению 






























Начальная концентрация водорода 0,8 моль/л, хлора 0,6 моль/л; константа скорости реакции равна 0,4 моль/(л∙с). Определить скорость реакции в начальный момент и по истечении некоторого времени, когда концентрация водорода уменьшится на 0,4 моля.
Ответ:0,192 моль/(л∙с); 0,032моль/(л∙с).
211.Средняя скорость реакции 



















 равна
равна
0,02моль/(л∙с). Каковы будут концентрации веществ А, В и С через 50 с после начала реакции, если начальные концентрации веществ А и В равны соответственно 2 и 4 моль/л?
Ответ: 1 моль/л: 3 моль/л; 1 моль/л.
212. При повышении температуры на каждые 





 скорость химической реакции увеличивается в 3 раза. Как изменится скорость этой реакции, если понизить температуру от 100 до 70°С?
скорость химической реакции увеличивается в 3 раза. Как изменится скорость этой реакции, если понизить температуру от 100 до 70°С?
Ответ: в 27 раз.
213. Две реакции при 30°С протекают с одинаковой скоростью 

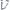








 . Температурный коэффициент первой реакции равен 2, второй 4. Как будут относится скорости обеих реакций
. Температурный коэффициент первой реакции равен 2, второй 4. Как будут относится скорости обеих реакций 





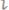




 , если реакцию проводить при 60°С?
, если реакцию проводить при 60°С?
Ответ: 1:8.
214. Определить температурный коэффициент реакции, если при охлаждении реакционной системы с 90 до 50°С скорость реакции уменьшилась в 256 раз.
Ответ: 4.
63

215. На сколько градусов нужно понизить температуру, чтобы скорость реакции уменьшилась в 128 раз, если температурный коэффициент равен 2?
Ответ: на 





 .
.
216. При 







 некоторая реакция заканчивается за 16 мин. Че-
некоторая реакция заканчивается за 16 мин. Че-
рез сколько минут закончилась бы эта реакция при 200°С и 100°С, если температурный коэффициент реакции равен 2?
Ответ: 0,5 мин; 512 мин.
217. Скорость реакции 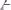

















 при повышении температуры на каждые
при повышении температуры на каждые 





 увеличивается в 2 раза. Во сколько раз увеличится скорость этой реакции при повышении температуры на
увеличивается в 2 раза. Во сколько раз увеличится скорость этой реакции при повышении температуры на 








Ответ: в 64 раза.
218.Температурный коэффициент некоторой реакции равен 3. При какой температуре следует проводить эту реакцию, чтобы скорость реакции, идущей при 120°С, уменьшилась в 9 раз?
Ответ: при 100°С.
219.Как изменится скорость реакции: а) при повышении температуры на 40°С; б) при понижении температуры на 30°С? Температурный коэффициент реакции равен 3.
Ответ: в 81 раз; в 27 раз.
220.При повышении температуры на 40°С скорость химической реакции увеличилась в 256 раз. Вычислить, во сколько раз увеличится скорость этой реакции при повышении температуры на каждые10°С.
Ответ: в 4 раза.
221.При нагревании диоксида азота в закрытом сосуде до неко-
торой температуры равновесие реакции |
устано- |
||
вилось |
при |
следующих |
условиях: |
|
|
|
. Найти |
константу равновесия для этой температуры и исходную концентрацию диоксида азота.
Ответ: |
. |
222. В сосуде находилась смесь трёх газообразных веществ с |
|
концентрациями |
. |
По истечении некоторого времени в сосуде установилось химическое равновесие: 























 . Вычислите концентрации всех ве-
. Вычислите концентрации всех ве-
ществ в момент равновесия, если известно, что концентрация вещества А уменьшилась на 30%.
64

Ответ: СА=0,7 моль/л; СВ=1,9 моль/л; СС=0,21 моль/л.
223. Равновесие реакции 








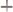





















 установилось
установилось
при |
следующих |
концентрациях |
реагирующих |
веществ: |
|
|
. |
Определить константу равно- |
|
весия и исходные концентрации оксида углерода и хлора.
Ответ:100;0,02 моль/л;0,02моль/л.
224. Для каких из указанных реакций уменьшение объема вызовет нарушение равновесия? Указать направление смещения равновесия.
225.При 100°С некоторая реакция заканчивается за 243 минуты. Принимая температурный коэффициент реакции равным 3, рассчитайте, сколько минут понадобится для окончания этой реакции при 150°С.
Ответ: 1 минута.
226.Температурный коэффициент реакции равен 2. При какой температуре следует проводить эту реакцию, чтобы скорость реакции, идущей при 60°С, уменьшить в 8 раз?
Ответ: при 30°С.
227.Во сколько раз уменьшится скорость химической реакции при понижении температуры на 100°С, если температурный коэффициент равен 2.
Ответ: в 1024 раза.
228. |
При |
состоянии |
равновесия |
системы |
|
|
концентрации участвующих в реакции ве- |
||
ществ равны: |
|
|
. |
|
Каковы были исходные концентрации водорода и азота? |
|
|||
Ответ: |
. |
|
|
|
229. |
При синтезе фосгена устанавливается химическое равнове- |
|||
сие |
|
. Вычислить исходные концентрации хло- |
||
|
|
65 |
|
|

ра и |
оксида |
углерода (II), |
если равновесные |
концентрации |
|
|
, |
, |
. |
Ответ: |
|
. |
|
|
230. При нагревании диоксида азота в закрытом сосуде до неко- |
||||
торой |
температуры равновесие |
реакции |
|
|
установилось |
при |
следующих |
условиях: |
|
|
|
|
|
. Най- |
дите константу равновесия для этой температуры и исходную концентрацию диоксида азота.
|
Ответ: ~4; |
. |
|
|
|
|
231. Равновесие реакции |
установи- |
|||
лось |
при |
следующих |
концентрациях |
реагирующих |
ве- |
ществ |
|
|
. |
Как |
|
изменятся скорости прямой и обратной реакций, если уменьшить объемы, занимаемые газами, в 3 раза? Сместится ли при этом равновесие? Ответ подтвердить расчетом.
Ответ: в 27 раз; в 9 раз.
232. Куда сместится равновесие в реакциях:



















 ,
, 











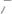
















 ,
,
































 ,
,

































 ,
,
а) при повышении температуры; б) при повышении давления; в) при понижении концентрации исходных веществ?
233. При разложении карбоната кальция в замкнутом сосуде устанавливается равновесие:
Как следует изменить условия проведения этой реакции, чтобы при той же температуре довести её до конца?
234. Рассчитать, как изменятся скорости прямых и обратных реакций в равновесных системах
при увеличении давления в 3 раза; исходя из результатов расчета, определить, как отразится это изменение давления на равновесии указанных систем.
66

235. Как будет влиять увеличение температуры, давления и концентрации исходных продуктов на состояния равновесия следующих реакциий:












 ;
;












 ;
;



























 ;
;
236. Вычислите концентрацию |
(моль/л) в реакции |












 , если известно, что в момент равновесия
, если известно, что в момент равновесия









































 , а константа равновесия равна 8. Ответ: 12моль/л.
, а константа равновесия равна 8. Ответ: 12моль/л.
Способы выражения концентрации растворов
Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя.
Пример 1. Вычислите: а) процентную 








 : б) молярную (
: б) молярную (


 ); в) эквивалентную (
); в) эквивалентную (


 ); г) моляльную (
); г) моляльную (



 ) концентрации раствора
) концентрации раствора 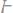







 , полученного при растворении 18 г кислоты в
, полученного при растворении 18 г кислоты в 










 воды, если плотность (ρ) его
воды, если плотность (ρ) его 











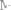

 . Чему равен титр Т этого раство-
. Чему равен титр Т этого раство-
ра?
Решение. а) Массовая процентная концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Так как массу 





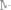

 воды можно принять
воды можно принять
равной 282 г, то масса полученного раствора 18+282=300 г и, следовательно:
в300г раствора – 18г кислоты
в100г – х
67

б) молярная концентрация, или молярность, показывает число молей растворенного вещества, содержащихся в 1 л раствора:
Масса 1 л раствора составляет 1031г.
Массу кислоты в литре раствора находим из соотношения:
в300г раствора – 18г кислоты
в1031г – х
Молярность раствора получим делением числа граммов в 1 л раствора на молярную массу 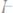


































в) эквивалентная концентрация, или нормальность, показывает число эквивалентных масс растворенного вещества, содержащихся в 1 л раствора:
Так как эквивалентная масса
то
г) моляльная концентрация, или моляльность, показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу 







 в 1000 г растворителя находим из соотношения:
в 1000 г растворителя находим из соотношения:
в282г растворителя – 18г кислоты
в1000г – х
68
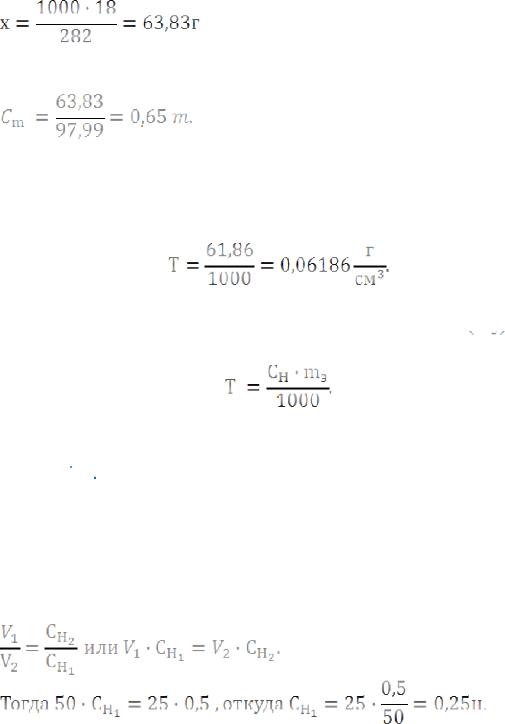
Отсюда
Титром раствора называется число граммов растворенного вещества в 


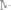


 (мл) раствора. Так как в 1 л раствора содержится 61,86 г кислоты, то
(мл) раствора. Так как в 1 л раствора содержится 61,86 г кислоты, то
Зная нормальность раствора и эквивалентную массу 






 растворенного вещества, титр легко найти по формуле:
растворенного вещества, титр легко найти по формуле:
Пример 2. На нейтрализацию 50 см3 раствора кислоты израсходовано 












 . раствора щелочи. Чему равна нормальность ки-
. раствора щелочи. Чему равна нормальность ки-
слоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.:
Пример 3. К 1 л 10%-ного раствора КОН (пл. 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (пл. 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение. Масса одного литра 10%-ного раствора КОН 1092 г. В этом растворе содержится (1092∙10)/100=109,2 г КОН. Масса 0,5 л
69
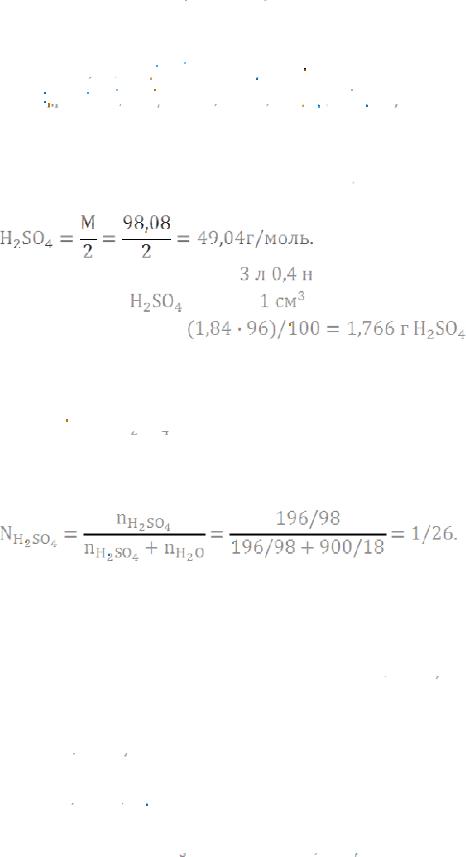
5%-ного раствора 




















 . В этом растворе содержится
. В этом растворе содержится
(522,5∙5)/100=26,125 г КОН.
В общем объеме полученного раствора (2 л) содержание 



 составляет
составляет 


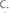


























 . Отсюда молярность этого раствора
. Отсюда молярность этого раствора 






























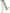






















 – молярная масса
– молярная масса 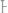




 .
.
Пример 4. Какой объем 96%-ной серной кислоты плотностью 1,84г/см3 потребуется для приготовления 

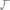






 . раствора?
. раствора?
Решение. Эквивалентная масса
Для |
приготовления |
. |
раствора |
требуется |
|
49,04∙0,4∙3=58,848 г |
. Масса |
96%-ной кислоты 1,84 г. В |
|||
этом растворе содержится |
|
|
|
. Следова- |
|
тельно, для приготовления 3л 0,4н. раствора надо взять
58,848/1,766=33,32 см3 этой кислоты.
Пример 5. Какова молярная доля серной кислоты в растворе, содержащем 
















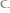





 воды.
воды.
Решение. Молярная доля компонента раствора равна отношению числа молей этого компонента к сумме чисел молей всех компонентов раствора.
КОНТРОЛЬНЫЕ ВОПРОСЫ
237. Вычислите молярную и эквивалентную концентрации 20%-нoго раствора хлорида кальция плотностью 










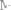


 .
.
Ответ: 2,1 М; 4,2 н.
238.Чему равна нормальность 















 раствора
раствора 



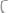


 плотностью
плотностью 














 ? К I л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора.
? К I л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора.
Ответ: 


















239.Вычислите эквивалентную и моляльную концентрации 20,8%-ного раствора 







 плотностью
плотностью 











 . Сколько граммов
. Сколько граммов
кислоты содержится в 4 л этого раствора?
70
