
химия + методичка / kontr_z
..pdf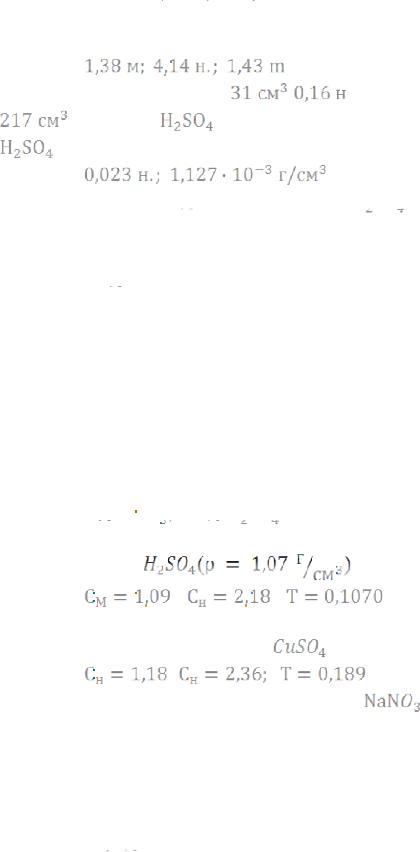
Ответ: 3.70 н.; 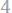















240.Вычислите молярную, эквивалентную и моляльную концентрации 16%-ного раствора хлорида алюминия плотностью 1,149 г/см3.
|
Ответ: |
|
|
|
241. На нейтрализацию |
. раствора щелочи требует- |
|
ся |
раствора |
. Чему равны нормальность и титр раство- |
|
ра |
? |
|
|
|
Ответ: |
|
|
242.К 500 мл 














 раствора
раствора 



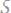




 (ρ=1,07 г⁄см3) добавили 200 мл 20%-ного её раствора (ρ=1,07 г⁄см3). Вычислите процентную концентрацию конечного раствора.
(ρ=1,07 г⁄см3) добавили 200 мл 20%-ного её раствора (ρ=1,07 г⁄см3). Вычислите процентную концентрацию конечного раствора.
Ответ: 






243.Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCl. Чему равна процентная концентрация полученного раствора?
Ответ: 32,5%.
244.Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова процентная концентрация полученного раствора.
Ответ:45,72%.
245.Смешали 800 кг 30%-ного раствора серной кислоты с 200 кг 20%-ного раствора азотной кислоты. Вычислите процентную концентрацию серной и азотной кислот в смеси.
Ответ: 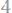













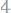







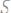





 246. Рассчитайте молярную, нормальную концентрацию и титр
246. Рассчитайте молярную, нормальную концентрацию и титр
10%-ного раствора |
|
. |
|
Ответ: |
; |
; |
|
247. Вычислите молярную, нормальную концентрацию и титр |
|||
16%-ного раствора сульфата меди |
(ρ=1,18г⁄см3). |
||
Ответ: |
; |
|
|
248. Какое количество нитрата натрия |
необходимо взять |
||
для приготовления 300 мл 0,2 М раствора? Ответ: 5,1 г.
249. Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна процентная концентрация охлажденного раствора?
Ответ: 








71
250. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна процентная концентрация оставшегося раствора?
Ответ: 

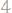

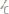


251. Какова молярность и титр раствора, содержащего 10 г едко-
го натра |
в 600 мл водного раствора? |
|
|
||
Ответ: |
|
|
|
|
|
252. |
Определить молярную концентрацию и титр раствора, со- |
||||
держащего 19,6 г серной кислоты |
в 700 мл водного раствора. |
||||
Ответ: |
. |
|
|
|
|
253. |
Какова молярная доля тетрахлорида углерода |
в рас- |
|||
творе, содержащем 308г |
и 416г дихлорэтана |
? |
|
||
Ответ: 0,323. |
|
|
|
|
|
254.Вычислить процентное содержание KOH в 1,95н. растворе ρ=1,092 г⁄см3
Ответ: 10%
255.1 л воды смешали с 250 мл 50%-ного раствора азотной ки-
слоты 






 (ρ=1,3 г⁄см3). Вычислите процентную и нормальную
(ρ=1,3 г⁄см3). Вычислите процентную и нормальную
концентрацию полученного раствора.
Ответ: 12,26%; 2,06н.
256.Определить молярную и нормальную концентрации, а также титр раствора, содержащего 21 г фторида калия KF в 600 мл водного раствора.
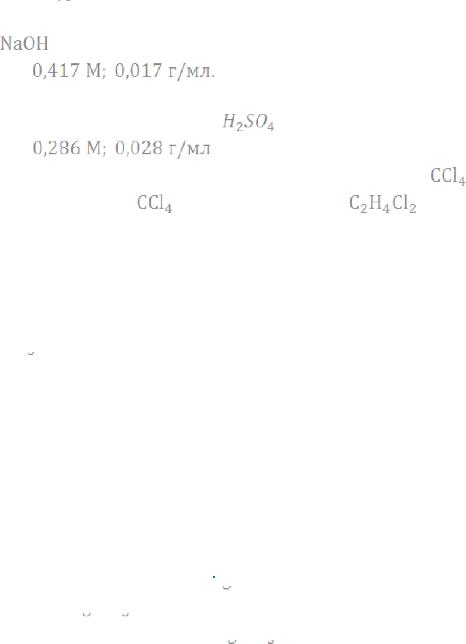
Ответ:0,6 М; 0,6 н.; 0,035 г/мл.
257.Сколько миллилитров 96%-ной серной кислоты ρ=1,84г⁄см3 потребуется для приготовления 3л 0,4 н. раствора?
Ответ: 33,3 мл.
258.Для осаждения в виде 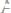





 всего серебра, содержащегося в
всего серебра, содержащегося в
100 мл раствора 










 , потребовалось 50 мл 0,2н. раствора HCl. Чему равна нормальность раствора
, потребовалось 50 мл 0,2н. раствора HCl. Чему равна нормальность раствора 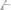










 ? Сколько граммов AgCl вы-
? Сколько граммов AgCl вы-
пало в осадок?
Ответ:0,1 н; 1,433г AgCl.
259. Выразить в процентах концентрацию раствора, содержащего в 460г воды 45г сульфата меди CuSO4. Какова моляльность этого раствора?
Ответ: 8,91%; 0,61m
72

260.К 1 л 10%-ного раствора КОН (ρ=1,092г⁄ м3 прибавили 0,5 л 5%-ного раствора КОН (ρ=1,045г⁄см3). Вычислить молярную концентрацию полученного раствора.
Ответ: 1,6 М.
261.К 1л 6%-ного раствора 



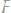




 (ρ=1,031г⁄см3) прилили 2л во-
(ρ=1,031г⁄см3) прилили 2л во-
ды. Вычислить молярную, нормальную концентрацию и титр полученного раствора.
Ответ |
|
(ρ=1,054г⁄см3) прибавили 2л |
262. К |
1л 10%-ного раствора |
2%-ного раствора той же кислоты (ρ=1,009г⁄см3). Вычислите молярную концентрацию и титр полученного раствора.
Ответ: 

















263. Какой процентной концентрации получится азотная кислота, если к 500 мл 32%-ной кислоты (плотность 1,2 г/см3) прибавить 1 л воды?
Ответ:12 %.
264. К 3 л воды прибавили 1 л 30%-ного раствора NaOH (ρ=1,328г⁄см3). Рассчитайте молярную концентрацию и титр полученного раствора.
Ответ: 








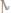


























265. К 200 г 10%-ного раствора KNO3 добавили 10 г кристаллического 







 , Какова процентная концентрация полученного раство-
, Какова процентная концентрация полученного раство-
ра.
Ответ: 14,29%.
266.К 200 граммам 30%-ного раствора NaCl прилили 100г 10%- ного раствора этой же соли. Какова процентная концентрация полученного раствора?
Ответ: 23,33 %.
267.На нейтрализацию 10 мл раствора, содержащего в 1л 11,2г щелочи, было израсходовано 20мл 0,1н. раствора кислоты. Вычислите эквивалент щелочи.
Ответ: 56.
268.Имеется 10%-ный раствор серной кислоты (ρ=1,07 г⁄ см3). Вычислить молярность, нормальность, моляльность и молярную долю в нем серной кислоты.
Ответ: 1,09 моль/л; 2,18н.; 1,13моль/кг; 0,02.
73

269. К 3 л 10%-ного раствора 






 (ρ=1,054г⁄см3) прибавили 5л 2%-ного раствора той же кислоты (ρ=1,009г⁄см3). Вычислить про-
(ρ=1,054г⁄см3) прибавили 5л 2%-ного раствора той же кислоты (ρ=1,009г⁄см3). Вычислить про-
центную и молярную концентрацию полученного раствора.
Ответ: 5%; 0,82М
270. Смешали 10 л 10%-ного раствора HNO3 (ρ=1,056г⁄см3). и 100 л 30%-ного раствора 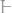







 (ρ=1,184г⁄см3). Вычислить процент-
(ρ=1,184г⁄см3). Вычислить процент-
ную концентрацию полученного раствора.
Ответ: 28,36%
271.На нейтрализацию 20 мл раствора, содержащего в 1 л 12 г щелочи, было израсходовано 24мл 0,25н. раствора кислоты. Рассчитать эквивалентную массу щелочи.
Ответ: 40 г/моль.
272.Смешали 247г 62%-ного и 145г 18%-ного раствора серной кислоты. Какова процентная концентрация полученного раствора?
Ответ: 45,72%
Свойства растворов
Пример 1. Вычислите температуры кристаллизации и кипения 2%-ного водного раствора глюкозы 








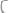



Решение. По II закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора 

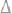



 по срав-
по срав-
нению с температурами кристаллизации и кипения растворителя выражаются уравнением:
где К – криоскопическая или эбуллиоскопическая константа. Для воды они соответственно равны 1,86 и 0,52°С; m2 и М2 – соответственно масса растворенного вещества и его молярная масса; m1 – масса растворителя.
Понижение температуры кристаллизации 2%-ного раствора 



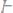







 находим из формулы (1):
находим из формулы (1):
Вода кристаллизуется при 0°С, следовательно, температура кристаллизации раствора 0-0,21= -0,21°С.
74

Из формулы (1) находим и повышение температуры кипения 2%-ного раствора:
Вода кипит при |
, следовательно, температура кипения это- |
го раствора |
. |
Пример 2. Раствор, |
содержащий 1,22 г бензойной кислоты |














 в 100 г сероуглерода, кипит при 46,529°С. Температура
в 100 г сероуглерода, кипит при 46,529°С. Температура
кипения сероуглерода 46,3°С. Вычислите эбуллиоскопическую константу сероуглерода.
Решение. Повышение температуры кипения ∆t=46,529-46,3= =0,229°С. Молярная масса бензойной кислоты 122 г/моль. Из формулы (1) находим эбуллиоскопическую константу:
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислить молярную массу глицерина.
Решение. Температура кристаллизации чистой воды 0°С, следовательно, понижение температуры кристаллизации ∆t=0-(-0,279)= =0,279°С. Из формулы (1) находим молярную массу глицерина:
Пример 4. Вычислить осмотическое давление раствора, в 100мл которого содержится 4,5г ацетона 



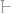










 при 25°С.
при 25°С.
Решение. Согласно осмотическому закону Вант-Гоффа:
(2),
где Росм – осмотическое давление, кПа или атм.; СM – молярная концентрация раствора, моль/л;
R – газовая постоянная, равная 8,31 Дж/(моль∙К) или 0,082л∙атм/(моль∙К);
Т – температура, К;
где m – масса растворенного вещества, г; М – его молярная масса, г/моль; V – объем раствора, л. Из уравнения (2):
75

Пример 5.Давление пара раствора 27 г неэлектролита в 108 г воды при 75°С равно 270,1 мм рт.ст. Вычислить молярную массу неэлектролита. Давление пара воды при 75°С равно 289,1 мм рт.ст. Решение. Согласно 1 закону Рауля:
где 
 – понижение давления пара растворителя над раствором;
– понижение давления пара растворителя над раствором;
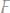


 – давление пара над чистым растворителем; Р – давление пара над раствором, мм рт.ст. или кПа;
– давление пара над чистым растворителем; Р – давление пара над раствором, мм рт.ст. или кПа; 



 – молярная доля растворенного вещества;
– молярная доля растворенного вещества; 

 – количество молей растворителя;
– количество молей растворителя;




 – количество молей растворенного вещества. Для приближенных расчетов используем формулу:
– количество молей растворенного вещества. Для приближенных расчетов используем формулу:
Рассчитаем 


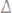


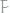










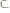













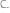















 Из 1 закона Рауля:
Из 1 закона Рауля:
Пример 6 Температура кипения раствора, содержащего 9,22 г 







 в 100 г воды, равна 100,797°C . Вычислить степень диссоциации
в 100 г воды, равна 100,797°C . Вычислить степень диссоциации 







 .
.
Решение. Степень диссоциации электролита можно найти по формуле:
где 

 – степень диссоциации;
– степень диссоциации;
i – изотонический коэффициент;
n – число ионов, на которое распадается при диссоциации молекула электролита. Поскольку 


















 распадается на 2 иона,
распадается на 2 иона, 


 . Изотонический коэффициент
. Изотонический коэффициент  может быть рассчитан как отношение
может быть рассчитан как отношение 

 ,
, 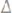 t
t крист.,
крист.,  t
t кип,P
кип,P осм, найденных на опыте, к тем же вели-
осм, найденных на опыте, к тем же вели-
76

чинам, |
вычисленным без учета диссоциации электролита ( , |
tкрист., |
tкип,Pосм). |




































 .
.
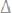





 р-ра рассчитаем, исходя из 2-го закона Рауля.
р-ра рассчитаем, исходя из 2-го закона Рауля.
где 








 – повышение температуры кипения раствора,
– повышение температуры кипения раствора, 


 ;
;
Kэ – эбуллиоскопическая константа воды, равная 0,52


 ; Сm – моляльная концентрация раствора, моль/1000г H2O;
; Сm – моляльная концентрация раствора, моль/1000г H2O; 


 – масса растворителя, г;
– масса растворителя, г; 



 – масса растворённого вещества, г;
– масса растворённого вещества, г;
М2 – молярная масса растворённого вещества, г/моль.
Зная i, рассчитаем 
 :
:
КОНТРОЛЬНЫЕ ВОПРОСЫ
273.Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296°С. Температура кристаллизации бензола 5,5°С. Криоскопическая константа 5,1°C. Вычислите молярную массу растворенного вещества.
Ответ: 128 г/моль.
274.Вычислите процентную концентрацию водного раствора
сахара 













 , зная, что температура кристаллизации раствора
, зная, что температура кристаллизации раствора
-0,93°С. Криоскопическая константа воды 1,86°C.
Ответ: 14,6%, 275. Вычислите температуру кристаллизации раствора мочеви-
ны 















 , содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86°C.
, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86°C.
77

Ответ: -1,03°С.
276. Раствор, содержащий 3,04 г камфоры 










 в 100 г бен-
в 100 г бен-
зола, кипит при 80,714°С. Температура кипения бензола 80,2°С. Вычислите эбуллиоскопическую константу бензола.
Ответ: 2,57°C .
277. Вычислите процентную концентрацию водного раствора глицерина 
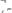













 , зная, что этот раствор кипит при 100,39°C.
, зная, что этот раствор кипит при 100,39°C.
Эбуллиоскопическая константа воды 0,52°C .
Ответ: 6,45%.
278.Вычислите молярную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при -0,279°С. Криоскопическая константа воды 1,86°C.
Ответ: 60 г/моль.
279.Вычислите температуру кипения 5%-ного раствора нафта-
лина 




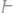


 в бензоле. Температура кипения бензола 80,2°С, эбуллио-
в бензоле. Температура кипения бензола 80,2°С, эбуллио-
скопическая константа его 2,57°C.
Ответ: 81,25°С.
280.Раствор, содержащий 25,65г некоторого неэлектролита в 300 г воды, кристаллизуется при -0,465 °С. Вычислите молярную массу растворённого вещества. Криоскопическая константа воды 1,86°C.
Ответ: 342г/моль.
281.Какую массу анилина 









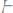


 следует растворить в 50 г
следует растворить в 50 г
этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53°C. Эбуллиоскопическая константа этилового эфира 2,12°C.
Ответ: 1,16 г.
282. Вычислите температуру кристаллизации 2%-нoго раствора этилового спирта 


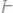





 . Криоскопическая константа воды 1,86°C.
. Криоскопическая константа воды 1,86°C.
Ответ: -0,82°С.
283.Сколько граммов мочевины 














 следует растворить
следует растворить
в75 г воды, чтобы температура кристаллизации понизилась на 0,465°? Криоскопическая константа воды 1,86°C.
Ответ: 1,12 г.
284.Вычислите процентную концентрацию водного раствора
глюкозы 











 , зная, что этот раствор кипит при 100,26°С. Эбул-
, зная, что этот раствор кипит при 100,26°С. Эбул-
лиоскопическая константа воды 0,52°C.
Ответ: 8,25%,
78

285. Сколько граммов фенола 
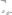








 следует растворить в
следует растворить в
125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7°? Криоскопическая константа бензола 5,1°C.
Ответ: 3,91 г.
286.Сколько граммов мочевины 














 следует растворить
следует растворить
в250 г воды, чтобы температура кипения повысилась на 0,26°C? Эбуллиоскопическая константа воды 0,52°. Ответ: 7,5 г,
287.При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372°. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 92 г/моль.
288.Раствор, содержащий в 1 литре 3,75г формалина, обладает осмотическим давлением 2,8 атм. при 0°C. Определить молярную массу формалина.
Ответ: 30 г/моль
289.Определить молярную массу анилина, зная, что при 30°С давление пара раствора, содержащего 3,09 г анилина в 370 г эфира













 равно 643,6 мм рт.ст., а давление пара чистого эфира при
равно 643,6 мм рт.ст., а давление пара чистого эфира при
той же температуре разно 647,9 мм рт.ст. Ответ: 93 г/моль.
290. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25г антрацена 




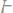



 в 100 г уксус-
в 100 г уксус-
ной кислоты, кристаллизуется при 15,718°С. Температура кристаллизации уксусной кислоты 16,65°C.
Ответ: 3,9°C.
291.Раствор, содержащий 6 г мочевины в 50 г воды, кристаллизуется при -3,72°С. Определить молярную массу мочевины.
Ответ:60 г/моль.
292.В каком количестве воды следует растворить 0,02 моля некоторого неэлектролита для получения раствора, температура кипения которого 100,026°C?
Ответ: 400 г.
293.Раствор, содержащий 8г сульфата алюминия 















 в
в
25 г воды, кристаллизуется при -4,46°С. Определить степень диссоциации соли в растворе.
Ответ: 39%.
79

294.Осмотическое давление раствора, содержащего 3 г сахара
в250 мл раствора, равно 0,82 атм. при 12°C. Определить молярную массу сахара.
Ответ: 342 г/моль.
295.При 50°С давление пара раствора, содержащего в 200 г
этилового спирта 








 23г растворенного вещества, равно
23г растворенного вещества, равно
207,2мм рт.ст. Давление пара чистого спирта при той же температуре равно 219,5мм рт.ст. Определить молярную массу растворенного вещества.
Ответ: ~ 92 г/моль.
296. Вычислить температуру кипения раствора, содержащего 100 г сахара 




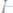








 в 750 г воды.
в 750 г воды.
Ответ: 100,20°С.
297. В каком количестве воды следует растворить 0,5кг глицерина 














 для получения раствора с температурой кристалли-
для получения раствора с температурой кристалли-
зации -3°С?
Ответ: 3,370кг.
298. Давление пара раствора, содержащего 0,05 моль сульфата натрия 











 в 450 г воды, равно 756,2 мм рт.ст. при 100°С. Оп-
в 450 г воды, равно 756,2 мм рт.ст. при 100°С. Оп-
ределить степень диссоциации 












 в этом растворе.
в этом растворе.
Ответ: 75%.
299. Вычислить осмотическое давление раствора, в 1,2 л которого содержится 20,5 г сахара 




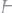








 при 22°С.
при 22°С.
Ответ: 1,2 атм.
300. Каково будет при 65°С давление пара раствора, содержащего 13,68 г сахара 




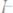








 в 90 г воды, если давление водяного па-
в 90 г воды, если давление водяного па-
ра при той же температуре составляет 187,5 мм рт.ст.? Ответ: 186 мм рт.ст.
301. Вычислить температуру кристаллизации 2%-ного раствора глюкозы 











 .
.
Ответ: -0,21°С.
302.Раствор, содержащий 1,22 г бензойной кислоты 



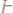










в100 г сероуглерода, кипит при 46,529°С. Температура кипения сероуглерода 46,3°С. Вычислить эбуллиоскопическую константу сероуглерода.
Ответ: 2,29°С.
80
