
химия + методичка / kontr_z
..pdf
щих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде?
Ответ: 5,03 г; 3,133 л, 6,266 л.
404.При электролизе соли некоторого металла в течении 1,5ч при силе тока 1,8А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла.
Ответ: 17,37 г/моль.
405.При электролизе раствора 







 на аноде выделилось 168
на аноде выделилось 168
см3 газа (н.у.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде. Ответ: 0,953 г.
406. При электролизе водных растворов каких из приведенных веществ происходит разложение воды: нитрат калия, хлорид натрия, хлорид меди, сульфат цинка, гидроксид калия, сульфат натрия. Привести схемы процессов, протекающих на электродах.
407.Электролиз раствора нитрата серебра проводили при силе тока 2А в течение 4ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса серебра выделилась на катоде и каков объем газа (н.у.), выделившегося на аноде?
Ответ: 32,2г; 1,67л.
408.При прохождении электрического тока силой 3А в течение 25 мин через раствор нитрата серебра на электроде (каком?) выделилось 4,8г серебра. Рассчитайте выход продукта в процентах от теоретического.
Ответ: 95,2%
409.На сколько граммов уменьшится масса серебряного анода,
если электролиз раствора 









 проводить при силе тока 2А в тече-
проводить при силе тока 2А в тече-
ние 38мин 20с? Составьте электронные уравнения процессов, происходящих на графитовых электродах.
Ответ: 5,14г.
410.Электролиз раствора 








 проводили с медным анодом в
проводили с медным анодом в
течение 4ч при силе тока 50 А. При этом выделилось 224 г меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода.
Ответ: 94,48 %.
411. При электролитическом осаждении всего железа из 300 мл раствора сульфата железа 








 на аноде выделилось 1,344 л (при
на аноде выделилось 1,344 л (при
101

н.у.) кислорода. Вычислите нормальную и молярную концентрации исходного раствора.
Ответ: раствор 0,8 н. или 0,4 М.
412. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора 









 . Если
. Если
электролиз проводить с серебряным анодом, то его масса уменьшается на 5,4 г. Определите расход электричества при этом.
Ответ: 4825 Кл.
413. Электролиз раствора 









 проводили в течение 15мин
проводили в течение 15мин
при силе тока 2,5А. Выделилось 0,72 г меди. Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной).
Ответ: 97,3% 414. Через две последовательно соединённые электролитические
ванны с платиновыми электродами, заполненными соответственно подкисленной водой и раствором хлорида меди 







 , пропустили
, пропустили
электрический ток. Какие продукты и в каком количестве выделились во второй ванне, если в первой на катоде выделилось 0,1г. водорода?
415.Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора 







 . Вычис-
. Вычис-
лите массу меди, выделившейся на катоде, если на аноде выделилось
560 мл газа (н.у.). Ответ: 1,588 г.
416.При полном электролитическом разложении 33,3г. хлорида некоторого двухвалентного металла выделилось 6,72л. (при н. у.) хлора. Определить, соль какого металла взята.
Ответ: кальций.
417.Какие процессы протекают на электродах и какие вещества выделяются при электролизе растворов с нерастворимыми электродами:
а) 








 , б)
, б) 








 , в)
, в) 







 , г)
, г) 







 , д)
, д) 







 . Написать схемы катодного и анодного процессов.
. Написать схемы катодного и анодного процессов.
418.Почему при электролизе расплава хлорида натрия и его водного раствора на электродах образуются разные вещества? Написать схемы процессов, происходящих на катоде и аноде.
419.В водном растворе содержатся катионы следующих метал-
лов: 









































 . Выделяемый металл – цинк.
. Выделяемый металл – цинк.
102

Какие из перечисленных примесей и в какой последовательности будут удаляться из электролита на инертных электродах без выделения основного металла – цинка. Ответ мотивируйте.
420. Какой объём водорода, измеренного при н.у., выделится на катоде при токе 5А в течении 2 часов из раствора 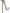









 ? Какое ве-
? Какое ве-
щество и в каком количестве выделится при этом на аноде?
421. Какие вещества и в каких количествах выделятся на электродах при электролизе раствора 














 при токе 0,5А в течении
при токе 0,5А в течении
30мин?
422.Вычислить химический и электрохимический эквивалент металла, если ток в 0,5А за 1ч 40 мин. выделил 1,52 г металла.
Ответ: 






























423.При электролизе сернокислой соли 2-х валентного металла на аноде выделилось 171мл кислорода (при н.у.), а на катоде за это же время 1г металла. Найти молярную массу атома металла.
Ответ: 64.
424.При прохождении электрического тока силой 5А в течение 30 мин через раствор нитрата серебра на электроде (каком?) выделилось 5,8 г серебра. Рассчитать выход продукта в процентах от теоретического.
Ответ: 57,6 %
425.Какие вещества и в каком количестве выделились на катоде
ианоде при электролизе раствора MgSO4 при токе в 3А в течение 0,6 часа?
Ответ: 0,067г; 0,537г.
426.Сколько электричества потребуется для выделения из рас-
твора:
а) 1г водорода; б) 1г кислорода; в) 1г хлора?
Ответ: 96500 Кл; 12063 Кл; 2722 Кл.
427.Какой объем водорода, измеренного при н.у., выделится на
катоде при токе 5А в течение 2 час из раствора 






 ? Ответ:4,18л.
? Ответ:4,18л.
428.Сколько времени нужно пропускать ток в 1А, чтобы выделить на аноде 0,5 эквивалентной массы хлора?
Ответы: 13,4 ч. (48250с.)
429.Какое вещество и в каком количестве выделится на аноде
при электролизе раствора 








 , если на катоде выделилось 1,589г меди?
, если на катоде выделилось 1,589г меди?
103

430.Сколько времени нужно пропускать ток в 10А через электролит, чтобы выделить из раствора 4,48 л хлора?
Ответ: 3860 с.
431.Через растворы 







 ,
, 






 и
и 









 последовательно
последовательно
пропускали ток в 2А в течении 20 минут. Какие вещества и в каких количествах выделились на инертных электродах в каждом случае?
432.При электролитическом осаждении всего железа из 300 мл раствора сульфата железа (II) на аноде выделилось 1,344 л (при н.у.) кислорода. Вычислить молярную концентрацию исходного раствора.
Ответ: 0.4 М.
433.Как изменились массы анода и катода при электролизе рас-
твора 








 c электродами из цинка, если через этот электролит про-
c электродами из цинка, если через этот электролит про-
пускали ток 4А в течении 2-х часов?
Ответ: ±9,76 г.
434.Через раствор сульфата цинка пропустили ток в течении 30 минут. При этом выделилось 0,25 г цинка. Амперметр показывал 0,4А. Какова ошибка в показаниях амперметра?
Ответ: 2,44 %
435.Сколько времени нужно пропускать через раствор кислоты электрический ток силой 10А, чтобы получить 5,6 л водорода, измеренного при нормальных условиях?
Ответ: 4825 с.
436.Какова нормальность раствора 









 , если для выделения
, если для выделения
всего серебра из 80 мл этого раствора потребовалось пропустить ток силой в 0,8 А в течении 20 мин ?
Ответ: 0,124н.
437. Через растворы 







 и
и 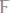







 пропускали ток силой 5А в
пропускали ток силой 5А в
течении 10 мин. В каком из растворов выделилось больше железа? Ответ подтвердите расчётом.
438. Сколько литров водорода выделится на катоде, если вести электролиз водного раствора 




 в течении 3 ч при силе тока 2А? Газ
в течении 3 ч при силе тока 2А? Газ
измерен при нормальных условиях. Ответ: 2,51 л.
439. Сколько алюминия можно получить при электролизе расплава 







 , если в течении 1 часа пропускать ток силой 20000А, при
, если в течении 1 часа пропускать ток силой 20000А, при
выходе по току 85%. Ответ: 5,7 кг.
104

440. Какова была сила тока при электролизе, если за 4 часа удалось выделить всю медь из 600 мл 0,8 н. раствора 








 ?
?
Ответ: 3,2А.
441. При электрическом осаждении всего железа из 300мл раствора 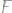









 на аноде выделилось 2240 мл кислорода, измеренного при нормальных условиях. Вычислить молярность раствора
на аноде выделилось 2240 мл кислорода, измеренного при нормальных условиях. Вычислить молярность раствора 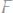









 .
.
Ответ: 0,67 М.
442. Насыщенный раствор медного купороса 









 cодержит 27%
cодержит 27% 








 (ρ=1,2г/см3). При какой силе тока можно в течении 3х ча-
(ρ=1,2г/см3). При какой силе тока можно в течении 3х ча-
сов выделить всю медь из 1 л такого раствора?
Ответ: 36,19А.
443.Какой силы ток нужно пропускать через расплавленный хлорид магния в течении 10 часов, чтобы при выходе по току 85% получить 0,5кг металлического магния?
Ответ: 129,8А.
444.Через раствор сульфата натрия пропускали ток в течении 2ч, в результате чего выделилось 2,24 л кислорода, измеренного при нормальных условиях. Определить силу тока. Составить схему электролиза этой соли.
Ответ: 5,36А.
445.Выход по току при получении металлического кальция при электролизе расплава хлорида кальция равен 70%. Сколько электричества надо пропустить через электролизёр, чтобы получить 200г кальция?
Ответ: 382А∙ч (1375200А∙с)
446.При электролизе водного раствора 








 c нерастворимы-
c нерастворимы-
ми электродами на аноде выделилось 6 л кислорода, измеренного при 27°С и 740 мм.рт.ст. Сколько граммов никеля выделилось на катоде?
Ответ: 27,8г.
Коррозия металлов.
При решении задач этого раздела см. табл. 5.
Коррозия – это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой.
105

При электрохимической коррозии на поверхности металла одновременно протекают два процесса: анодный – окисление металла
и катодный - восстановление ионов водорода:
или молекул кислорода, растворенного в воде:
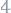




 .
.
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии – коррозии во влажном воздухе при комнатной температуре – деполяризатором является кислород.
Пример 1. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом (HCl) растворе. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный потенциал (-0,763В), чем кадмий (-0,403В), поэтому он является анодом, а кадмий – катодом.
Анодный процесс: 









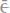





 Катодный процесс:
Катодный процесс:
вкислой среде: 

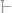


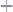











 вторичный процесс:
вторичный процесс: 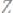




















внейтральней среде: 
























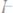


Так как ионы 





 с гидроксидной группой образуют нерастворимый гидроксид, то продуктом коррозии будет
с гидроксидной группой образуют нерастворимый гидроксид, то продуктом коррозии будет 











 :
:
вторичный процесс: 




























Пример 2. Какое из покрытий – анодное или катодное – эффективнее защищает металл от коррозии при нарушении целостности покрытия? Привести примеры. Составить электронные уравнения происходящих процессов в нейтральной среде.
Решение, Например, анодное покрытие – железо, покрытое хромом, а катодное покрытие – железо, покрытое никелем. Схемы образующихся при коррозии гальванических элементов (гальванопар):
106

Электронные уравнения процессов:
1) 


















Вторичный процесс: 















2) А















Вторичный процесс: 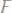





























.
Во втором случае при коррозии разрушается железо и образуется ржавчина FeO(OH), т.е. катодное покрытие менее эффективно защищает металл от коррозии.
Пример 3. Железная и медная пластинки опущены в раствор хлорида натрия. Какие процессы протекают на пластинках: 1) еслипластинки не соприкасаются между собой; 2) если наружные концы
пластинок соединены проводником? |
|
Решение. |
|
1) |
В соответст- |
вии с рядом напряжений: |
|
107
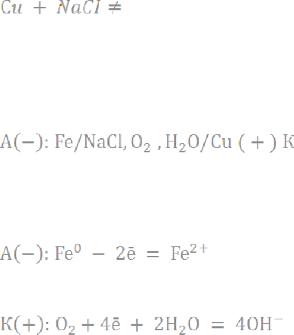
2) Образуется гальванический элемент (гальванопара):
КОНТРОЛЬНЫЕ ВОПРОСЫ
447.Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
448.Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов.
449.Как происходит атмосферная коррозия и коррозия в растворе HCI луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
450.Какой металл будет окисляться при нарушении целостности покрытия, если один металл покрыт другим: а) цинк – медью; б) железо – кадмием; в) железо – оловом; г) медь – алюминием; д) алюминий – серебром; е) медь – золотом; ж) медь – никелем; з) никель – медью. Напишите процессы, протекающие при коррозии металлов в кислой и нейтральной средах.
108
451.В чём сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород (например, в морской воде). Составьте электронные уравнения анодного и катодного процессов.
452.Железное изделие покрыли никелем. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
453.Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний – никель. Какие продукты коррозии образуются в первом и во втором случаях?
454.В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
455.Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
456.Какое покрытие металла называется анодным и какое – катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде.
457.Железное изделие покрыли кадмием. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
458.Железное изделие покрыли свинцом. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной)
109

кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
459.Две железные пластинки, частично покрытые одна оловом, другая – медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
460.Почему при водородной деполяризации (коррозия в кислой среде) перемешивание корродирующего электролита не ускоряет коррозию, а при кислородной деполяризации (коррозия в нейтральной среде) перемешивание и аэрация раствора способствуют коррозии?
461.Если опустить в разбавленную серную кислоту пластинку из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако, если цинковой палочкой прикоснуться к железной пластинке, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте электронные уравнения анодного и катодного процессов.
462.Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
463.Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий – железо. Какие продукты коррозии образуются в первом и во втором случаях?
464.Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
465.Составить схему и написать электронные уравнения процессов, протекающих при коррозии цинковой пластинки, соприкасающейся с хромовой и погруженной в водный раствор хлорида на-
трия и в раствор 







 .
.
466. Составить схему и написать электронные уравнения процессов, протекающих при коррозии медной пластинки, соприкасающейся с серебряной, в нейтральной среде и в растворе 



 .
.
110
