
химия + методичка / kontr_z
..pdf
303. Раствор 






 , в 500 мл которого содержится 5,35 г соли,
, в 500 мл которого содержится 5,35 г соли,
оказывает при 17,5°С осмотическое давление, равное 2,18атм. Вычислить изотонический коэффициент и степень диссоциации соли в растворе.
Ответ:~84%.
304.Вычислить осмотическое давление 0,25 молярного раствора сахара при 38°С. Ответ: 6,38 атм.
305.Давление пара воды при 25°С составляет 23,76 мм.рт.ст. Вычислить для той же температуры давление пара раствора, в 450 г
которого содержится 90 г глюкозы 











 .
.
Ответ: 23,17 мм.рт.ст.
306. В каком количестве воды следует растворить 23 г глицерина 









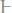




 , чтобы получить раствор с температурой кипения
, чтобы получить раствор с температурой кипения
100,104°С.
Ответ: 1250 г.
307.При растворении 0,4 г некоторого вещества в 10 г воды температура кристаллизации раствора понижается на 1,24°С. Вычислить молярную массу растворенного вещества.
Ответ: 60 г/моль.
308.Вычислить степень диссоциации 







 в растворе, содер-
в растворе, содер-
жащем 0,0995 моль 







 в 500 г воды. Температура кристаллизации
в 500 г воды. Температура кристаллизации
такого раствора равна -0,740°С. Ответ: 50%.
309. Вычислить осмотическое давление раствора при 17°С, если литр его содержит 18,4г глицерина 















 .
.
Ответ: ~4,6 атм.
310. Давление пара чистого ацетона 



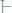










 при 20°С равно 179.6 мм.рт.ст. Вычислить давление пара раствора 2,5 г камфоры
при 20°С равно 179.6 мм.рт.ст. Вычислить давление пара раствора 2,5 г камфоры 










 в 100 г ацетона при той же температуре.
в 100 г ацетона при той же температуре.
Ответ: 177,52 мм.рт.ст.
311.Раствор, содержащий 1,477 г пероксида водорода в 100 г воды кристаллизуется при -0,805°С. Вычислить молярную массу пероксида водорода.
Ответ: 34 г/моль.
312.Температура кипения ацетона 



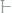










 равна 56,1°С, а его
равна 56,1°С, а его
эбуллиоскопическая константа 1,73°С. Вычислить температуру кипения 8%~ного раствора глицерина 










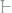




 в ацетоне.
в ацетоне.
81
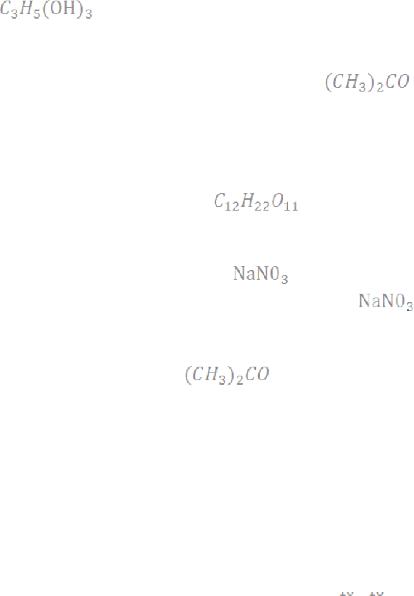
Ответ:57,73°С
313.Вычислить степень электролитической диссоциации 







в2 м растворе, если осмотическое давление раствора при 0°С равно
68,1 атм.
Ответ: 52%.
314.40 мл раствора, содержащего 0,2 г растворенного вещества, при 27°C обнаруживают осмотическое давление, равное 1,2 атм. Вычислить молярную массу растворенного вещества.
Ответ: 103 г/моль.
315.Чему равно давление пара раствора, содержащего 46 г
глицерина |
в 900 г воды при 40°С? Давление пара воды |
|
при 40°С равно 55,32 мм рт.ст. |
|
|
Ответ: 54,77 мм рт.cт. |
|
|
316. |
Раствор, содержащий 0,502 г ацетона |
В 100 г ле- |
дяной уксусной кислоты, обнаруживает понижение температуры кристаллизации на 0,339°С. Вычислить криоскопическую константу ук-
сусной кислоты. |
|
|
Ответ: 3,92°С. |
|
|
317. Сколько граммов сахара |
растворено в 1600 г во- |
|
ды, если раствор закипает при 100,104 С? |
|
|
Ответ: 109,44 г. |
|
|
318. Раствор, содержащий 8,5 г |
в 100 г воды, кристалли- |
|
зуется при -3,04°С. Вычислить степень диссоциации |
. |
|
Ответ :~63%.
319. Вычислить осмотическое давление раствора, в 100 мл ко-
торого содержится 4,5 г ацетона |
, при 0°C. |
Ответ: 17,37 атм. |
|
320.Давление пара раствора 27 г неэлектролита в 106 г воды при 75°С равно 270,1 мм рт.ст. Вычислить молярную массу неэлектролита. Давление пара воды при 75°С равно 289,1 мм рт.ст.
Ответ: ≈70 г/моль.
321.Сколько молей растворенного неэлектролита содержится в 250 г воды, если раствор кристаллизуется при -0,093°С.
Ответ:0,0125 моль.
322.Раствор, содержащий 3,04 г камфоры 










 в 100 г бен-
в 100 г бен-
зола, кипит при 80,714°С. Температура кипения бензола 80,2°С. Вычислить эбуллиоскопическую константу бензола.
Ответ: 2,57°С.
82

323. Температура кипения раствора, содержащего 9,22 г 






 в 100 г воды, равна 100,797°С. Вычислить степень диссоциации
в 100 г воды, равна 100,797°С. Вычислить степень диссоциации 






 .
.
Ответ: 70%.
324. Вычислить осмотическое давление при 27°С раствора сахара 













 , 1 литр которого содержит 91 г растворенного веще-
, 1 литр которого содержит 91 г растворенного веще-
ства.
Ответ: 6,5 атм.
325. При 0°С давление пара эфира 













 составляет 184,9мм рт. ст. Найти для той же температуры давление пара 5%-ного раствора анилина
составляет 184,9мм рт. ст. Найти для той же температуры давление пара 5%-ного раствора анилина 








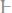

 в эфире.
в эфире.
Ответ: 177,1 мм.рт.ст.
326. Сколько граммов глюкозы











 следует растворить в
следует растворить в
260 г воды для получения раствора, температура кипения которого превышает температуру кипения чистого растворителя на 0,05°С?
Ответ: 4,5 г.
327. Раствор, содержащий 2,7 г фенола 



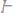





 в 75г бензола
в 75г бензола 






 , кристаллизуется при 3,5°С, тогда как чистый бензол кристалли-
, кристаллизуется при 3,5°С, тогда как чистый бензол кристалли-
зуется при 5,5°С. Определить криоскопичеекую константу бензола. Ответ: 5,2°С.
328. Осмотическое давление 0,01 н. раствора 







 составляет
составляет
при 37°С и 367 мм.рт.ст. Вычислить степень диссоциации соли.
Ответ: ~90%.
329. Рассчитать величину осмотического давления раствора, содержащего в литре 3,1г анилина 












 . Температура раствора
. Температура раствора
21°С.
Ответ: 0,8 атм.
330.Давление водяного пара равно 233,8 мм.рт.ст. при 70°С. При той же температуре давление пара раствора, содержащего в 270 г воды 12г растворенного вещества, равняется 230,68 мм.рт.ст. Определить молярную массу растворенного вещества.
Ответ: ~60 г/моль.
331.Вычислить температуру кристаллизации раствора мочеви-
ны 



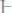










 , содержащего 3 г мочевины в 100 г воды.
, содержащего 3 г мочевины в 100 г воды.
Ответ: -0,93°С.
332. При растворении 15 г хлороформа в 400 г диэтилового эфира температура кипения повысилась на 0,663°С. Определить мо-
83

лекулярную массу хлороформа. Эбуллиоскопическая константа диэтилового эфира 2,12°С.
Ответ: 119,5 г/моль. |
|
333. Определить степень диссоциации сульфата калия |
в |
растворе, содержащем 8,7 г этой соли в 100 г воды, зная, что этот раствор кристаллизуется при -1,83°С.
Ответ: 48,5%.
334. В 250 мл раствора содержится 2,3 г растворенного вещества; осмотическое давление раствора при 27°С равно 2,45 атм. Вычислить молярную массу вещества.
Ответ: 92 г/моль.
335. Каково давление пара 10%-ного раствора мочевины 







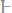






 при 100°С?
при 100°С?
Ответ: 734,7 мм.рт.ст.
336.Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислите молярную массу глицерина.
Ответ: 92 г/моль.
337.Температура кипения раствора, содержащего 3,05 г бен-
зойной кислоты 













 в 125 г хлороформа, равна 61,88°С. Тем-
в 125 г хлороформа, равна 61,88°С. Тем-
пература кипения хлороформа 61,12°С. Вычислить эбуллиоскопическую константу хлороформа.
Ответ: 3,8°С.
338. Вычислить давление пара 10%-ного раствора 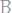














при 28°С. Давление пара воды при той же температуре составляет 28,35 мм рт. ст. Степень диссоциации соли 0,575.
Ответ: 27,88 мм.рт.ст.
339. Сколько граммов глюкозы 











 содержится в 200 мл
содержится в 200 мл
раствора, осмотическое давление которого при 37°С составляет
8атм.?
Ответ: 11,3г.
340. При 20°С давление водяного пара 17,5 мм.рт.ст. Сколько граммов глицерина 















 надо растворить в 180 г воды, чтобы
надо растворить в 180 г воды, чтобы
понизить давление пара на 1 мм рт.ст.? Ответ: 52,6г.
341. При растворении 3,24 г серы в 40 г бензола температура кипения последнего повысилась на 0,81°С. Из скольких атомов состоят молекулы серы в растворе? Эбуллиоскопическая константа бензола
2,57°С.
84

Ответ: 8.
342. При какой приблизительно температуре будет кристалли-
зоваться 40%-ный раствор этилового спирта |
? |
|
Ответ: -27°С. |
|
|
343. Если растворить 55,8 г |
в 5 кг воды, получится рас- |
|
твор, кристаллизующийся при -0,385°С. Вычислить степень диссоциации соли в растворе.
Ответ: 76,5 %.
344. В 750 мл раствора содержится 6,9 г растворенного вещества; осмотическое давление раствора при 27°С равно 2,46 атм. Вычислить молярную массу вещества.
Ответ: 92 г/моль.
345. Каково давление пара 5%-ного раствора мочевины 














 при 100°C?
при 100°C?
Ответ: 748 мм.рт.ст.
346.Раствор, содержащий 22,08 г глицерина в 1600 г воды, кристаллизуется при -0,279°С. Вычислите молярную массу глицерина.
Ответ: 92 г/моль.
347.Температура кипения раствора, содержащего 6,10 г бен-
зойной кислоты 













 в 250 г хлороформа, равна 61,88°С. Тем-
в 250 г хлороформа, равна 61,88°С. Тем-
пература кипения хлороформа 61,12°С. Вычислить эбуллиоскопическую константу хлороформа.
Ответ: 3,8°С.
348. Вычислить давление пара 20%-ного раствора 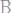















при 28°С. Давление пара воды при той же температуре составляет 28,35 мм.рт.ст. Степень диссоциации соли 0,575.
Ответ: 27,49 мм.рт.ст.
349. Чему равно при температуре -7,5°С осмотическое давление раствора, в 1,5 л которого содержится 276 г глицерина 










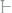




 ?
?
Ответ: 43,57 атм.
350. Вычислить давление 10%-ного водного раствора сахара 











 при 100°С.
при 100°С.
Ответ: 755,5 мм рт.ст.
351. При растворении 0,94 г фенола в 50 г этилового спирта температура кипения последнего повысилась на 0,232°С. Определить молярную массу фенола, зная, что эбуллиоскопическая константа спирта равна 1,16°С.
85

Ответ: 94 г/моль.
352. В каком весовом отношении надо смешать воду и этиловый спирт 







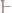
 , чтобы получить смесь, замерзающую при -20°С
, чтобы получить смесь, замерзающую при -20°С
(К=1,86°С).
Ответ: 2:1.
353. При растворении 25,5 г 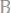






 в 750 г воды получается рас-
в 750 г воды получается рас-
твор, кристаллизующийся при -0,756°С. Вычислить степень диссоциации соли в растворе.
Ответ: 74%.
354. При какой температуре осмотическое давление раствора, содержащего в 1 л 45 г глюкозы 








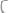


 достигнет 6 атм?
достигнет 6 атм?
Ответ: 19,7°С.
355. Давление пара воды при 20°С составляет 17,54 мм рт.ст. Сколько граммов сахара 













 следует растворить в 720 г воды
следует растворить в 720 г воды
для получения раствора, давление пара которого на 0,14 мм рт.ст. меньше давления пара воды?
Ответ: 109г.
356.Раствор, содержащий 5,4 г некоторого вещества в 200 г воды, кипит при температуре 100,078°С. Вычислить молярную массу растворенного вещества.
Ответ: 180 г/моль.
357.Вычислить температуру кристаллизации 10%-ного раство-
ра глицерина 










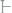




 в воде.
в воде.
Ответ: -2,24°С.
358. Раствор, содержащий 33,2 г 













 в 300 г воды, кипит
в 300 г воды, кипит
при 100,466°С. Вычислить степень диссоциации соли в растворе. Ответ: 56%.
359. Сколько граммов глюкозы 











 содержится в 400 мл
содержится в 400 мл
раствора, осмотическое давление которого при 37°С составляет 8 атм.?
Ответ: 22,6г.
360. При 20°С давление водяного пара 17,5 мм.рт.ст. Сколько граммов глицерина 














 надо растворить в 360 г воды, чтобы
надо растворить в 360 г воды, чтобы
понизить давление пара на 1 мм рт.ст.?
Ответ: 105,2г.
361. При растворении 6,48 г серы в 80г бензола температура кипения последнего повысилась на 0,81°С. Из скольких атомов состо-
86

ят молекулы серы в растворе? Эбуллиоскопическая константа бензола
2,57°С.
Ответ: 8.
362. При какой приблизительно температуре будет кристаллизоваться 20%-ный раствор этилового спирта 









 ?
?
Ответ: -10°С.
363. Если растворить 112,6 г 




 в 10 кг воды, получится рас-
в 10 кг воды, получится рас-
твор, кристаллизующийся при -0,38°С. Вычислить степень диссоциации соли в растворе.
Ответ: 75%.
Гальванические элементы
При решении задач этого раздела см. табл. 5.
Гальванический элемент – это система, в которой химическая энергия окислительно-восстановительных процессов превращается в электрическую энергию.
Если металлическую пластинку опустить в воду, то катионы металла на ее поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость катионами и поверхностью металла. В результате этого в системе устанавливается равновесие:
где n – число электронов, принимающих участие в процессе. На границе металл-жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала – электродным потенциалом. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обыч-
87

но определяют относительные электродные потенциалы в определенных условиях - так называемые стандартные электродные потенциалы







 .
.
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью), равной 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю 






 ;
; 




 0).
0).
Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е°), получаем так называемый ряд напряжений.
Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е°, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньшие окислительные способности проявляют его ионы, и наоборот. Электродные потенциалы измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстанови- тельная реакция, которая характеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение. В этом случае 








 , так как
, так как











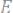

 .
.
Пример 1. Стандартный электродный потенциал никеля больше, чем кобальта (табл. 5). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001моль/л, a потенциал кобальта – в растворе с концентрацией
0,1моль/л?
Решение. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
где E° – стандартный электродный потенциал;
n – число электронов, принимающих участие в процессе;
88

С – концентрация ионов металла в растворе, моль/л; Е° для никеля и кобальта соответственно равны -0,25 и -0,277В.
Определим электродные потенциалы этих металлов при данных в условии концентрациях:
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Таблица 5. Стандартные электродные потенциалы (


 некоторых металлов
некоторых металлов
(ряд напряжений):
Электрод |
Е°,В |
Электрод |
E°.B |
Li+/Li |
-3,045 |
Cd2+/Cd |
-0,403 |
Rb+/Rb |
-2,925 |
Со2+/Со |
-0,277 |
K+/K |
-2,924 |
Ni2+/Ni |
-0,25 |
Cs+/Cs |
-2,923 |
Sn2+/Sn |
-0,136 |
Ba2+/Ba |
-2,90 |
Pb2+/Pb |
-0,127 |
Са2+/Са |
-2,87 |
Fe3+/Fe |
-0,037 |
Na+/Na |
-2,714 |
2H+/H2 |
-0,000 |
Mg2+/Mg |
-2,37 |
Sb3+/Sb |
+0,20 |
Al3+/Al |
-1,70 |
Bi3+/Bi |
+0,215 |
Ti2+/Ti |
-1,603 |
Cu2+/Cu |
+0,34 |
Zr4+/Zr |
-1,58 |
Cu+/Cu |
+0,52 |
Mn2+/Mn |
-1,18 |
Ag+/Ag |
+0,80 |
V2+/V |
-1, 18 |
Hg2+/Hg |
+0,85 |
Cr2+/Cr |
-0,913 |
Pt2+/Pt |
+1,19 |
Zn2+/Zn |
-0,763 |
Au3+/Au |
+1,50 |
Сr3+/Cr |
-0,74 |
Au+/Au |
+1,70 |
Fе2+/Fе |
-0,44 |
|
|
Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен -2,41 В. Вычислите концентрацию ионов магния (в моль/л).
Решение. Подобные задачи также решаются на основании уравнения Нернста (см. пример 1):
89
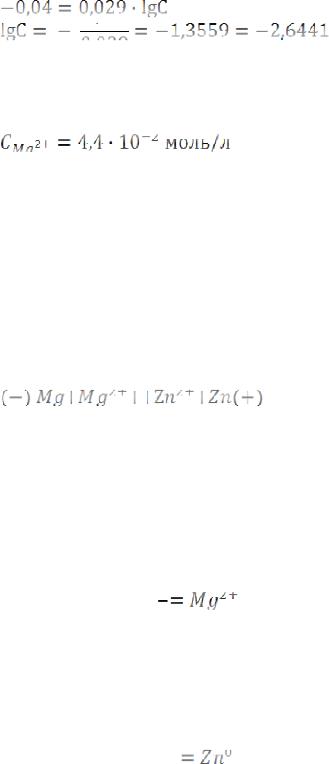
Пример 3.Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
(1)
Цинк, потенциал которого -0,763 В, – катод, т.е. электрод, на котором протекает восстановительный процесс:
(2).
90
