
химия + методичка / kontr_z
..pdf
тронов аналогичны АО. Их также называют электронными или атомными орбиталями. Электронное облако характеризуется четырьмя квантовыми числами (n, l, 



 , ms).Эти квантовые числа связаны с фи-
, ms).Эти квантовые числа связаны с фи-
зическими свойствами электрона, и число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число l (орбитальное) - момент количества движения (энергетический подуровень); число 


 (магнитное) – магнитный момент; ms – спин. Спин
(магнитное) – магнитный момент; ms – спин. Спин
электрона возникает за счет вращения его вокруг собственной оси. Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в АО могут находиться не более двух электронов, отличающихся своими спинами (mS=+1/2) В табл.1 приведены значения и обозначения квантовых чисел, а также число электронов на соответствующем энергетическом уровне и подуровне.
Таблица 1 Значение квантовых чисел и максимальное число электронов на
квантовых уровнях и подуровнях.
Глав- |
Зна- |
Обо- |
Значение ml |
Число |
Число |
Максимальное |
||
ное |
че- |
значе- |
|
орбита- |
орбита- |
число |
электро- |
|
кван- |
ние l |
ние |
|
лей на |
лей на |
нов |
|
|
товое |
|
поду- |
|
поду- |
уровне |
|
|
|
|
|
на |
|
на |
||||
число |
|
ров- |
|
ровне |
|
|
||
|
|
|
поду- |
|
уровне |
|||
n |
|
ней |
|
|
|
|
||
|
|
|
|
ровне |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
0 |
1s |
0 |
1 |
1 |
2 |
|
2 |
2 |
0 |
2s |
0 |
1 |
4 |
2 |
|
8 |
1 |
2p |
-1;0;+1 |
3 |
6 |
|
|||
|
|
|
|
|||||
3 |
0 |
3s |
0 |
1 |
9 |
2 |
|
18 |
1 |
3p |
-1;0;+1 |
3 |
6 |
|
|||
|
2 |
3d |
-2; -1;0;+1; +2 |
5 |
|
10 |
|
|
|
0 |
4s |
0 |
1 |
|
2 |
|
|
4 |
1 |
4p |
-1;0;+1 |
3 |
16 |
6 |
|
32 |
2 |
4d |
-2; -1;0;+1; +2 |
5 |
10 |
|
|||
|
|
|
|
|||||
|
3 |
4f |
-3; -2; -1;0;+1; +2; +3 |
7 |
|
14 |
|
|
Пример 2. Составьте электронные формулы атомов элементов с порядковыми номерами 15 и 22. Покажите распределение электронов по квантовым (энергетическим) ячейкам.
Решение. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атом-
21

ным орбиталям). Электронная конфигурация обозначается группами символов nlx , где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, р, d, f), х – число электронов в данном подуровне.
При этом следует учитывать, что электрон раньше занимает тот энергетический подуровень, на котором он обладает наименьшей энергией, т.е. меньшая сумма n+l (I правило Клечковского).
Если у подуровней суммы n+l одинаковы, то первым заполняется тот подуровень, у которого «n» меньше (II правило Клечковского).
Последовательность заполнения энергетических уровней и подуровней следующая:
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И.Менделеева, то для элементов № I6 (сера) и № 22 (титан) электронные формулы имеют вид:
Электронная структура атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде прямоугольни-
ка □, а электроны в этих ячейках обозначают стрелками. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Гунда).
Один из вариантов размещения электронов: s
: |
1 |
|
|
p |
|
|
|
|
|
|
|
↑↓ |
|
|
|
|
|
d |
|||||
|
2 |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|
|
|
|||
|
3 |
↑↓ |
↑↓ |
↑ |
↑ |
|
|
|
|
|
|
|
|
|
|
|
|
22 |
|
|
|
|
|
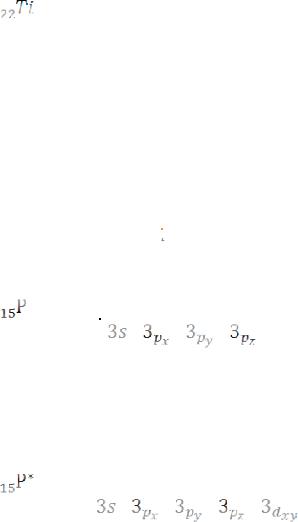
|
|
s |
|
|
|
|
|
|
|
|
: |
1 |
|
|
p |
|
|
|
|
|
|
↑↓ |
|
|
|
|
d |
|||||
|
2 |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|
|
|||
|
3 |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑ |
↑ |
|
|
|
|
4 |
↑↓ |
|
|
|
|
|
|
|
|
Пример 3. Какую валентность, обусловленную неспаренными электронами, может проявлять фосфор в нормальном и возбужденном состояниях?
Решение. Распределение электронов внешнего энергетического уровня фосфора… 










|
|
s |
p |
|
|
|
d |
|||
: |
3 |
↑↓ |
↑ |
↑ |
↑ |
|
|
|
|
|
Атомы фосфора имеют свободные d - орбитали, поэтому возможен переход одного 3 s - электрона в 3d-состяние:
|
s |
p |
|
|
|
d |
|||
: 3 |
↑ |
↑ |
↑ |
↑ |
↑ |
|
|
|
|
Отсюда валентность фосфора в нормальном состоянии равна трем, а в возбужденном состоянии – пяти.
Пример 4. Что такое электроотрицательность? Какая из связей в молекуле цианида калия (KCN) характеризуется большим процентом ионности?
Решение. Электроотрицательность (ЭО) характеризует способность атомов оттягивать от других атомов электроны при образовании химической связи. ЭО равна полусумме энергии ионизации и сродства к электрону. Обычно пользуются относительными значениями ЭО, т.е. отношениями ЭО данного элемента к ЭО лития, величину которого условно принимает за 1. Например, относительные ЭО фтора, кислорода, азота и калия равны соответственно 4,0; 3,5; 3,0; 0,8. Значения относительных ЭО сведены в таблицу (таблицу Полин-
23
га). Чем больше разница относительных ЭО соединяющихся атомов, тем большей ионностью обладает связь между ними. В цианиде калия две связи:
К – С: 2,5 - 0,8 = 1,3 С – N: 3,0 - 2,5 = 0,5
Значит, большим процентом ионности обладает связь К – С.
КОНТРОЛЬНЫЕ ВОПРОСЫ
41.Запишите, в какой последовательности заполняются электронами орбитали элемента радона Rn (порядковый номер 86). К какому семейству принадлежит данный элемент?
42.Почему при одинаковой конфигурации внешнего электронного уровня атомов азота и фосфора, кислорода и серы, фтора и хлора элементы этих пар различаются между собой по валентным возможностям?
43.Какие связи (ионная, ковалентная неполярная, полярная) осуществляются в соединениях: фосфорной кислоте, хлоре, диоксиде серы, хлориде натрия, хлороводороде?
44. Какую валентность проявляет германий |
в |
невозбужденном и возбужденном состояниях? |
|
45.Запишите, в какой последовательности заполняются
электронами орбитали элемента фермия |
(порядковый номер 100). |
Ккакому семейству принадлежит данный элемент?
46.Какая из двух связей в молекуле HOCl обладает наибольшей ионностью ? Ответ подтвердите расчетом. (ЭО: H=2,1; O=3,5; Cl=3,0).
47.Какая из трех связей в роданиде калия KSCN обладает большей ионностью? Ответ подтвердите расчетом. (ЭО: К=0,8; С=2,5; N=3,0; S=2,5).
48.Какую валентность может проявлять атом сурьмы в невозбужденном и возбужденном состояниях?
49.Атомы каких элементов в невозбуждённом состоянии имеют следующие структуры внешнего уровня:
а) |
|
p |
б) |
|
p |
|
в) |
|
p |
|||||
|
s |
|
|
s |
|
|
|
s |
|
|||||
|
↑↓ |
↑ |
↑ |
|
|
↑↓ |
↑ |
↑ |
↑ |
|
↑↓ |
|
|
|
24

50. Исходя из величин электроотрицательностей, укажите, как в приведенном ряду 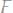











 изменится способность атомов прини-
изменится способность атомов прини-
мать электроны. (ЭО: F=4,0; Cl=3,0; Br=2,8; I=2,2)
51. Сколько свободных f-орбиталей содержится в атомах элементов с порядковыми номерами 59, 69, 93, 98? Пользуясь правилом Гунда, распределите электроны по орбиталям для атомов этих элементов.
52.Запишите, в какой последовательности заполняются электронами орбитали элемента калифорния (порядковый номер 98). К какому семейству принадлежит данный элемент?
53. Какие ошибки допущены в схемах распределения электронов внешних уровней в невозбуждённых атомах? Устраните ошибки.
Бор |
|
|
|
Азот |
|
|
|
Кислород |
||||||
|
s |
p |
s |
p |
|
s |
|
p |
||||||
|
↑ |
↑ |
↑ |
|
|
↑↓ |
↑↓ |
↑ |
|
|
↑↓ |
↑↓ |
↑↓ |
|
54.Какую валентность (максимальную) может проявлять
свинец?
55.Запишите, в какой последовательности заполняются
электронами орбитали элемента золота (порядковый номер 79). К какому семейству принадлежит данный элемент?
56.Какие связи, δ- или π-, образуются в молекулах водорода, фтора, хлороводорода, кислорода, диоксида углерода?
57.Охарактеризовать четырьмя квантовыми числами следующие состояния электронов (для каждого электрона):
3s |
|
3p |
|
↑↓ |
↑↓ |
↑ |
↑ |
58.Какую валентность может проявлять кремний в невозбужденном и возбужденном состояниях?
59.Запишите, в какой последовательности заполняются
электронами орбитали элемента свинца (порядковый номер 82). К какому семейству относится данный элемент?
60. Рассчитайте максимальное число электронов на s-, p-, d- и f- подуровнях.
25

61.Рассчитайте максимальное число электронов на 1, 2, 3 и 4 энергетических уровнях.
62.Охарактеризуйте четырьмя квантовыми числами следующие состояния электронов:
|
|
s |
|
|
p |
|
|
d |
||||
4 |
|
↑↓ |
|
↑↓ |
↑↓ |
↑ |
↑ |
↑ |
↑ |
|
|
|
63. Какая |
из |
связей: |
|
|
|
|
|
обладает |
||||
наибольшей ионностью, в сторону какого из атомов смещено связующее электронное облако? (ЭО: 


















Ge=1,8; S=2,5).
64.Какие валентные состояния может проявлять атом селена в невозбужденном и возбужденном состояниях?
65.Запишите, в какой последовательности заполняются
электронами орбитали элемента нептуния |
(порядковый номер 93). |
Ккакому семейству принадлежит данный элемент?
66.Какое количество электронных пар принимает участие в образовании связи в молекулах: брома, кислорода, азота и воды?
67.Охарактеризовать четырьмя квантовыми числами следующие состояния электронов (для каждого электрона):
d
5 ↑↓ ↑ ↑ ↑ ↑
68.Какую валентность может проявлять атом кремния в невозбужденном и возбужденном состояниях?
69.Чем можно объяснить, что фтор и хлор, имея одинаковую электронную конфигурацию s2p5 внешнего электронного уровня атомов, могут проявлять различную валентность: фтор – 1, хлор –
1,3,5,7?
70.Чем объяснить периодичность в свойствах элементов при последовательном увеличении зарядов ядер атомов?
71.Почему сера и кислород, являясь электронными аналогами (s2p4) проявляют различные валентности: кислород – только 2, а сера
–2, 4, 6?
72.Запишите, в какой последовательности заполняются электронами орбитали элемента платины (порядковый номер 78).
26

73.Пользуясь правилом Гунда, распределите электроны по орбиталям, соответствующим низкому энергетическому состоянию для атомов с порядковыми номерами 21, 35, 37, 52.
74.Какую валентность может проявлять атом хлора в невозбужденном и возбужденном состояниях?
75.Запишите, в какой последовательности заполняются электронами орбитали элемента тантала Та (порядковый номер 73). К какому семейству принадлежит данный элемент?
76.Какую валентность проявляет теллур (порядковый номер 52)
внормальном и возбужденном состояниях?
77.Охарактеризовать четырьмя квантовыми числами следующие состояния электронов (для каждого электрона):
2 |
s |
p |
||
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|
78. Какую валентность может проявлять атом висмута в невозбужденном и возбужденном состояниях?
79.Запишите, в какой последовательности заполняются электронами орбитали элемента вольфрама W (порядковый номер 74). К какому семейству принадлежит данный элемент?
80. Какие химические связи (ионная, ковалентная полярная, неполярная) осуществляются в веществах: фтороводороде HF, фториде рубидия RbF, этане 





 , диоксиде углерода, серной кислоте, кисло-
, диоксиде углерода, серной кислоте, кисло-
роде, водороде, хлориде натрия NaCl? (ЭО: H=2,1; F=4,0; Rb=0,8; C=2,5; O=3,5; S=2,5; Na=0,9; Cl=3,0).
81.Какой подуровень заполняется электронами раньше: 7s, 6p
или 6d?
82.При наличии какой из связей -σ- или -π-, затруднено вращение атомов углерода в молекуле углеводорода?
83.Какую максимальную валентность может проявлять атом
осмия?
84.Запишите, в какой последовательности заполняются электронами орбитали элемента менделевия Md (порядковый номер 101).
Ккакому семейству принадлежит данный элемент?
85.Учитывая способность молекул воды к образованию водородных связей, объясните, почему плотность льда меньше, чем плотность жидкой воды?
86.Учитывая значение электроотрицательностей элементов, оцените, какая связь в ряду хлоридов элементов II периода наиболее и
27

какая наименее полярна: LiCl, BeCl2, CCl4, NCl3, OCl2, FCl. (ЭО: Li=1,0; Be=1,5; C=2,5; N=3,0; O=3,5; F=4,0; Cl=3,0).
87.Запишите, в какой последовательности заполняются электронами орбитали элемента висмута Bi (порядковый номер 83). К какому семейству принадлежит данный элемент?
88.Для атома с электронной структурой 1s22s22p3 впишите в
таблицу значения квантовых чисел |
определяющие каж- |
дый из электронов в нормальном состоянии.
89. Охарактеризовать четырьмя квантовыми числами следующие состояния электронов (для каждого электрона):
s p
2 ↑↓ ↑↓ ↑↓ ↑↓
90.Запишите, в какой последовательности заполняются электронами орбитали элемента астата At (порядковый номер 85). К какому семейству принадлежит данный элемент?
91.Какая из трех связей в молекуле гремучей кислоты HOCN обладает наибольшим процентом ионности? Ответ подтвердите рас-
четом. (ЭО: H=2,1; C=2,5; N=3,0; O=3,5)
92.Как изменится ионность химической связи у фторидов элементов третьего периода периодической системы с увеличением номера элемента?
93.Какую максимальную валентность может проявлять атом марганца?
94.Запишите, в какой последовательности заполняются
электронами орбитали элемента полония |
(порядковый номер 84). |
Ккакому семейству принадлежит данный элемент?
95.Какие связи (ионная, ковалентная полярная, неполярная) осуществляются в соединениях: кислороде, бромоводороде, этане,
фториде калия, диоксиде азота? (ЭО: O=3,5; H=2,1; Br=2,8; C=2,5; F=4,0; K=0,8; N=3,0)
96.Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
97.Какая из приведенных связей 





















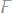

 наибо-
наибо-
лее приближается к ионной? (ЭО: Cs=0,86; Cl=3,0; Ca=1,0; S=2,5; Ba=0,97; F=4,0)
28
98.Напишите электронные формулы атомов элементов с порядковыми номерами 25 и 34. К какому электронному семейству относится каждый из этих элементов? Распределите электроны этих атомов по квантовым ячейкам.
99.Напишите электронную формулу атома элемента с порядковым номером 79.
100.Составьте электронные формулы атомов элементов с порядковыми номерами 50 и 79, учитывая, что у последнего происходит "провал" одного 6s-электрона на 5d-подуровень. К какому электронному семейству принадлежит каждый из этих элементов?
101.В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне p-7 или d-12 электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 52 и укажите его валентные электроны.
102.Сколько и какие значения может принимать магнитное
квантовое число ml при орбитальном числе l=0, 1, 2 и 3? Какие элементы в периодической системе называют s-, p-, d- и f- элементами? Приведите примеры.
103.Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Сколько свободных d-орбиталей в атомах этих элементов?
104.Пользуясь правилом Гунда, распределите электроны по орбиталям, отвечающим высшему энергетическому состоянию атомов: фосфора, алюминия, кремния, серы.
105.Какие орбитали атома заполняются электронами раньше: 4d или 5s, 6s или 5p? Почему? Напишите электронную формулу атома элемента с порядковым номером 104.
106.Почему вода обладает аномально высокими Тпл и Ткип по сравнению с соединениями водорода с другими p-элементами VI группы таблицы Д.И.Менделеева?
107.Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s- и р- элементов в группах периодической системы с увеличением порядкового номера? Почему?
108.Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательностей атомов соответствующих элементов определите, какая из связей: HI, HCl, BrF – наиболее полярная. (ЭО: H=2,1; Cl=3,0; I=2,2; Br=2,7, F=4,0)
29
109.Вычислить степень ионности связей в молекулах CBr4, CaC2, CO, B4C. В какой связи степень ионности наибольшая и наи-
меньшая? (ОЭ: С=2,5; Br=2,8; O=3,5; Ca=1,0; B=2,0)
110.Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами?
111.Какую ковалентную связь называют σ-связью и какую π- связью? Разберите на примере строения молекулы кислорода.
112.Как изменится ионность химической связи у фторидов элементов третьего периода периодической системы с увеличением но-
мера элемента? (ЭО: Na=1,0; Mg=1,2; Al=1,5; Si=1,7; P=2,1; S=2,5; Cl=3,0; F=4,0)
113.Какую химическую связь называют водородной? Между
молекулами каких веществ она образуется? Почему H2O и HF, имея меньшую молярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?
114.Распределите электроны атома углерода по квантовым ячейкам. Сколько неспаренных электронов может быть у атома углерода в нормальном и возбужденном состояниях? Какую валентность углерод при этом проявляет?
115.Распределите электроны атома хлора по квантовым ячейкам. Сколько неспаренных электронов может быть у атома хлора
внормальном и возбужденном состояниях? Какую валентность хлор при этом проявляет?
116.Распределите электроны атома фосфора по квантовым ячейкам. Сколько неспаренных электронов может быть у атома фосфора в нормальном и возбужденном состояниях?
117.У какого из элементов – кальция или цинка – более выражены металлические свойства? Ответ обоснуйте на основании анализа электронных формул Ca и Zn.
118.Что такое сродство к электрону? В каких единицах оно выражается? Как изменится окислительная активность атомов в периоде и в группе периодической системы с увеличением порядкового номера. Ответ мотивируйте строением атома соответствующего элемента.
119. Распределите электроны атома азота и фосфора по квантовым ячейкам. Объясните, почему для азота пятивалентное состояние невозможно, а для фосфора возможно.
30
