
химия + методичка / kontr_z
..pdf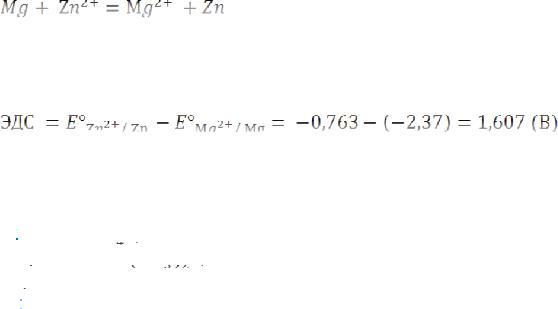
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного
(2) процессов:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
Пример 4. Увеличится или уменьшится масса цинковой
пластины, |
опущенной |
в растворы следующих солей: |
, |
, |
, |
. |
|
Решение: а)


















б) 






















 в)
в)



 г)
г) 



Из ряда напряжений следует, что каждый металл (не разлагающий воду) способен вытеснить из растворов солей те металлы, которые стоят после него в ряду напряжений, т.е. имеют большую алгебраическую величину Е°. Следует также иметь ввиду, что водород вытесняют из растворов кислот (кроме HNO3) только те металлы, которые имеют отрицательное значение Е°, т.е. стоят до водорода в ряду напряжений.
В реакциях а) и б) часть цинка переходит в раствор (в виде
растворимых солей |
и |
, а на пластине выделяются |
эквимолярные количества |
|
и , вытесненные цинком из растворов |
их солей. Молярные массы: Zn=64,5 г/моль; Cu=63,5 г/моль; Pb=207,1г/моль.
91

а) 64,5 > 63,5 – масса пластинки уменьшится; б) 64,5< 207,1 – масса пластинки увеличится. Реакции в) и г) не протекают, поэтому масса пластинки не изменится.
КОНТРОЛЬНЫЕ ВОПРОСЫ
364.В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй – серебряную.
Вкаком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронное и молекулярное уравнение соответствующей реакции.
365.Составьте схемы двух гальванических элементов, в одном из которых никель является анодом, а в другом – катодом. Выразите электронными уравнениями процессы, происходящие при работе этих элементов. Вычислите ЭДС этих элементов, если электроды погружены в 0,001М растворы своих солей.
366.Увеличится, уменьшится или останется без изменения масса стальной пластинки при взаимодействии её с растворами?
а) |
в) |
д) |
|
б) |
г) |
е) |
. |
Составьте ионные и молекулярные уравнения соответствующих реакций.
367.ЭДС гальванического элемента, состоящего из медного и никелевого электродов, равна 0,59В. Изменится ли величина ЭДС, если взять 0,0001М растворы? Ответ подтвердите расчётом.
368.Марганцевый электрод в растворе его соли имеет потенци-
ал -1,23 В. Вычислите концентрацию ионов 





 (в моль/л). Ответ:
(в моль/л). Ответ: 



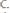







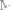











369.Потенциал серебряного электрода в растворе
составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Аg+ (в моль/л)?
Ответ: 0,20 моль/л.
370.Стальная пластинка была погружена в раствор 







 . Ко-
. Ко-
гда пластина покрылась слоем меди, её вынули из раствора, обмыли,
92

высушили и взвесили. Масса пластинки увеличилась на 2г. Сколько граммов меди выделилось на пластинке?
Ответ: 16,5г.
371. При какой концентрации ионов 


















 значение
значение
потенциала медного электрода становится равным стандартному по-
тенциалу водородного электрода? Ответ: 1,89∙10-12 моль/л
372. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй – в 0,1 н. растворы .
Ответ: 0,059 В.
373. Никелевую пластинку погрузили в раствор 








 . Через
. Через
некоторое время пластинку вынули из раствора, обмыли, высушили и взвесили. Масса пластинки увеличилась на 5г. Сколько граммов серебра выделилось на пластинке? Ответ подтвердите расчётом.
Ответ: 6,87г.
374. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если =0,01 моль/л,
Ответ: 0,064 В.
375.Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
376.Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии:
а) с раствором 







 б) с раствором
б) с раствором 








 в) с раствором
в) с раствором 











 г) с раствором
г) с раствором 







377. Гальванический элемент состоит из оловянного электрода, опущенного в 0,1М раствор 








 , и водородного электрода, погруженного в раствор с концентрацией ионов
, и водородного электрода, погруженного в раствор с концентрацией ионов 

 , равной 10-4моль/л. Со-
, равной 10-4моль/л. Со-
ставить схему элемента, написать уравнение реакций, происходящих на электродах, рассчитать ЭДС этого элемента.
93
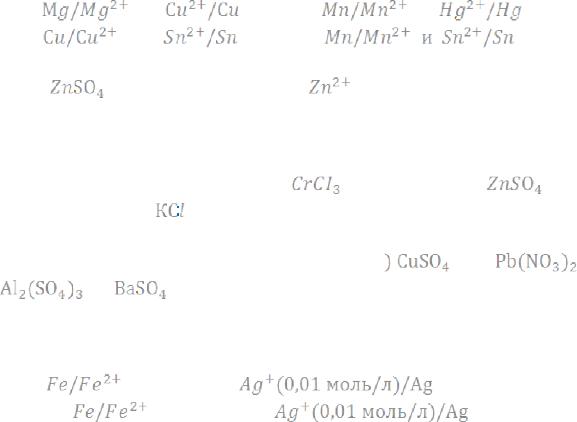
Ответ: 0,041 В.
378.Составьте два гальванических элемента, в одном из которых медь была бы анодом, а в другом – катодом. Рассчитать ЭДС в образованных гальванических элементах в стандартных условиях.
379.Принимая стандартный потенциал водородного электрода равным нулю, рассчитать потенциал водородного электрода, погруженного в раствор с рН=4.
Ответ: -0,232 В.
380.Принимая стандартный потенциал водородного электрода равным нулю, рассчитать потенциал водородного электрода, погруженного в чистую воду.
Ответ: -0,406 В.
381.Из данных электродов составить схемы гальванических элементов и на основании стандартных электродных потенциалов определить, в каком гальваническом элементе ЭДС будет больше:
а) |
и |
или |
и |
б) |
и |
или |
|
382. Вычислить электродный потенциал цинка, погруженного в |
|||
раствор |
с концентрацией ионов |
равной: а) 0,1 моль/л, |
|
б) 0,01 моль/л; в) 0,001 моль/л.
Ответ: ~ -0,789 В; ~ -0,818 В; ~ -0,847 В 383. Увеличится или уменьшится масса алюминиевой пластинки
при взаимодействии: а) с раствором |
, б) с раствором |
. |
|||
в) с раствором . Ответ подтвердите расчетом. |
|
|
|||
384. |
Увеличится или уменьшится масса цинковой пластины, |
||||
опущенной в растворы следующих солей: a |
, б) |
, |
|||
в) |
, г) |
? Ответ подтвердите расчетом. |
|
|
|
385. |
Вычислить ЭДС и определить направление движения элек- |
||||
тронов во внешней цепи гальванических элементов, составленных из следующих электродов:
а) |
(1 моль/л) и |
б) |
(0,1 моль/л) и |
Ответ: 1,124 В; 1,153 В.
386. Рассчитать ЭДС электрохимической цепи, образованной из одного и того же металла, погруженного в растворы своей соли с концентрацией ионов данных металлов 0,1 моль/л и 0,0001 моль/л:
94

a) 







 б)
б) 




 . Определить направление движения электро-
. Определить направление движения электро-
нов во внешней цепи.
Ответ: 0,087 В; 0,087 В.
387. Два разных металла погружены в 0,0001 М водные растворы своих солей. Составить схемы гальванических элементов и вычислить ЭДС, определить направление движения электронов во внешней цепи для следующих электродов:
a) 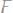





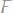









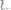










б) 










 и
и 













Ответ :0,78 В; 0,342 В 388. Рассчитать ЭДС электрохимической цепи, образованной
электродами из одного и того же металла, погруженных в растворы своей соли с концентрацией ионов металла 1 моль/л и 0,00001 моль/л:
а) 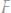



 б)
б) 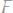






Ответ: 0,145 В; 0,145 В.
389. Вычислить ЭДС гальванического элемента, состоящего из
никелевого электрода, погруженного в 0,01 М раствор соли |
и |
|
золотого электрода, погруженного в 0,0001 М раствор |
. |
|
Ответ: 1,73 В. |
|
|
390.Назвать три металла, которые могут быть использованы в качестве анода гальванического элемента, катодом которого является свинец. Составить схемы этих элементов и указать процессы, происходящие при их работе. Рассчитать ЭДС в стандартных условиях.
391.Составить схемы двух гальванических элементов, в одном из которых никель играл бы роль анода, в другом – катода, написать электронные уравнения процессов, происходящих на электродах и рассчитать ЭДС гальванических элементов в стандартных условиях.
392.Вычислить ЭДС гальванического элемента, составленного
из медного электрода, погруженного в 0,001 М раствор 








 и стан-
и стан-
дартного водородного электрода.
Ответ: 0,253 В.
393. Электродами гальванического элемента являются две серебряные пластинки, одна из которых погружена в 1М раствор нитрата серебра, а другая – в 0,0001М раствор той же соли. В каком направлении перемещаются электроны при его работе? Рассчитать ЭДС этого гальванического элемента.
Ответ: 0,232 В.
95

394.Составить схемы двух гальванических элементов, в одном из которых железо играло бы роль анода, а в другом – катода. Написать электронные уравнения процессов, происходящих на электродах
ирассчитать ЭДС этих элементов при условии, что металлы погружены в 0,001 М растворы их солей.
395.Два водородных электрода погружены: один – в водный
раствор щелочи 


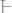





 , другой – в подкисленную воду
, другой – в подкисленную воду 








 .
.
Определить направление движения электронов и рассчитать ЭДС полученного гальванического элемента.
Ответ: 0,348 В.
396.Вычислить ЭДС гальванического элемента, состоящего из водородного электрода, погруженного в подкисленную воду 








ижелезного электрода, погруженного в 0,0001 М раствор нитрата же-
леза (II).
Ответ: 0,44 В.
397.Потенциал марганцевого электрода, помещенного в раствор его соли, составил -1,238 В. Вычислить концентрацию ионов 







 в
в
моль/л.
Ответ: 0,01 моль/л.
398. Написать схему концентрационного гальванического элемента, составленного из оловянных пластинок, опущенных в водные растворы своих солей с концентрациями: 




















 и
и
























 . Рассчитать ЭДС элемента.
. Рассчитать ЭДС элемента.
Ответ: 0,059 В.
399. Вычислить концентрацию ионов 



 (моль/л) в растворе, в
(моль/л) в растворе, в
котором потенциал водородного электрода равен -232мВ. Ответ: 0,0001 моль/л.
400.Вычислить рН растворов, в которых потенциалы водородного электрода составляют: а) -174 мВ; б) -290 мВ; в) -116 мВ.
Ответ: 3; 5; 2.
401.Рассчитать потенциал водородного электрода, погруженно-
го в раствор с 


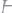




 .
.
Ответ: -0,59 В.
402. Гальванический элемент состоит из оловянного электрода, погруженного в 0,1М раствор 






 и свинцового электрода, погруженного 0,0001М раствор
и свинцового электрода, погруженного 0,0001М раствор 







 . Какой электрод будет анодом, а какой – катодом? Составьте схему и рассчитайте ЭДС этого элемента.
. Какой электрод будет анодом, а какой – катодом? Составьте схему и рассчитайте ЭДС этого элемента.
96
Ответ: 0,079 В.
Электролиз
Окислительно-восстановительные реакции, протекающие на электродах при прохождении постоянного электрического тока через раствор или расплав электролита, называется электролизом.
Пример 1. Какие процессы протекают на электродах при электролизе растворов солей:
а) с нерастворимыми (инертными) электродами; б) с растворимым анодом.
Написать процессы на электродах при электролизе раствора NiSO4 с нерастворимыми (графитовыми) электродами и растворимым анодом (из Ni).
Решение. Особенностью электролиза растворов является наличие в них наряду с ионами электролита молекул воды, которые также участвуют в процессах, протекающих на электродах. Необходимо руководствоваться следующими правилами:
1. На аноде из анионов электролитов в первую очередь окисля-
ются анионы бескислородных кислот (Cl-, Br-, S2-, CN-, и т.д., кроме
F-).
2.Анионы кислородсодержащих кислот (













 и т.д., а также
и т.д., а также 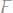


 ) не окисляются – вместо них окисляются молекулы воды.
) не окисляются – вместо них окисляются молекулы воды.
3.Катионы активных металлов (Li…Al) на катоде не восстанавливаются – вместо них восстанавливаются молекулы воды.
Например, электролиз раствора NaNO3 протекает по схеме:
4.Катионы металлов средней активности (Mn…Pb) восстанавливаются одновременно с молекулами воды.
Например, электролиз раствора Zn(NO3)2:
5.Катионы неактивных металлов, имеющих положительные значения электродных потенциалов (Cu…Au) восстанавливаются в первую очередь.
Например, раствор CuCl2:
97

При электролизе с растворимым анодом металл анода «отдает» электроны во внешнюю цепь источнику постоянного тока, а сам в виде катионов переходит в раствор; эти катионы принимают участие в проводимости второго рода, как составная часть внутренней цепи.
Например, электролиз раствора CuSO4 с медным анодом протекает по схеме:
Электролиз растворов с растворимым анодом широко используется в технике (гальваностегия, рафинирование металлов, гальванопластика и др.)
Электролиз раствора NiSO4: а) с нерастворимым анодом:
б) с растворимым анодом:
Пример 2. Какая масса меди выделится на катоде при электролизе раствора 






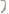

 в течение 1ч при силе тока 4А?
в течение 1ч при силе тока 4А?
Решение. Согласно законам Фарадея
Примечание. Если на электродах выделяются газообразные вещества, то объем выделившегося газа рассчитывается по формуле:
где m – масса вещества, окисленного или восстановленного на электроде, г;
mэ – эквивалентная масса этого вещества, г/моль; I – сила тока, А;
98

t – продолжительность электролиза, с; 96500 A∙c – число Фарадея (или 28,8 A∙ч); V0 – объём выделившегося газа, л;
Vэ – эквивалентный объем газа.
Эквивалентная масса меди в 









 равна 63,54:2 =31,77г/моль.
равна 63,54:2 =31,77г/моль.
Подставив в формулу (1) значения: mэ=31,77; I=4 A; t=60∙60= 3600с,
получим:
Пример 3. Вычислите эквивалентную массу металла, зная, что при электролизе раствора хлорида этого металла затрачено 3380Кл электричества и на катоде выделяется 11,742 г металла.
Решение. Из формулы (1)
где m= 11,742 г; I·t=Q=3880 Кл.
Пример 4. Чему равна сила тока при электролизе раствора, если в течение 1ч 40мин 25с на катоде выделилось 1,4 л водорода (н.у.)?
Решение. Из формулы (1)
.
Так как дан объем водорода, то отношение 










 заменяем отношением:
заменяем отношением:












 ,
,
где 




 – объем водорода, л;
– объем водорода, л;





 – эквивалентный объем водорода, л. Тогда
– эквивалентный объем водорода, л. Тогда
|
|
|
|
. |
|
|
Эквивалентный объем водорода при н.у. равен половине моляр- |
||||||
ного объема |
|
|
л. Подставив в приведенную формулу зна- |
|||
чения |
, |
, |
(1ч 40мин |
|
), |
|
|
||||||
находим: |
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
99

Пример 5. При электролитическом осаждении всей меди из 500 мл раствора сульфата меди на аноде выделилось 2,24 л (н.у.) кислорода. Определить молярную концентрацию исходного раствора.
Решение. На основании второго закона Фарадея определим массу выделившейся меди:



















































 Масса выделившегося кислорода равна:
Масса выделившегося кислорода равна:
В 1 л раствора содержалось |
или |


















 Следовательно, концентрация исходного раствора была
Следовательно, концентрация исходного раствора была 















 .
.
Примечание: тот же результат можно получить, если вести расчет по формуле:
где – эквивалентный объём кислорода (5,6л).
КОНТРОЛЬНЫЕ ВОПРОСЫ
403.Электролиз раствора 
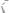








 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходя-
проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходя-
100
