
- •Химическая связь
- •Астрахань
- •1. Ковалентная связь
- •1.1. Молекулярные орбитали1
- •1.2. Механизмы образования ковалентной связи
- •1.3. Особенности ковалентной связи
- •Кратность
- •Насыщаемость
- •Направленность
- •Гибридизация атомных орбиталей
- •Полярность
- •Поляризуемость
- •2. Ионная связь
- •3. Металлическая связь
- •4. Водородная связь
- •Вопросы для самоконтроля
Направленность
Орбитали атомов, участвующие в образовании молекулярных орбиталей, имеют разную форму и разную ориентацию в пространстве. Это обусловливает направленность ковалентных связей, поскольку соединяемые атомы стремятся к максимальному перекрыванию их орбиталей.
Направленность ковалентных связей характеризуется валентными углами (углами между соседними связями). Например, молекулы СН4, NH3, H2O имеют строго определённые значения валентных углов. Длина и валентные углы ковалентных связей определяют пространственную структуру (геометрию) молекул и многоатомных ионов.
Геометрия молекулы — это взаимное пространственное расположение её атомов, которое определяется длинами связей и валентными углами. Геометрия молекулы во многом определяет физические и химические свойства вещества. Представления метода валентных связей позволяют объяснить геометрию многих молекул. Например, атомы элементов VIA-группы в основном состоянии имеют по два неспаренных р-электрона, облака которых вследствие электростатического отталкивания располагаются перпендикулярно друг другу (рис. 6 а). При образовании молекул водородных соединений (гидридов) H2S, H2Se и H2Te две р-орбитали атомов соответствующих элементов перекрываются с s-орбиталями атомов водорода, образуя ковалентные связи, угол между которыми близок к 90°(табл. 1). Исключение составляет молекула воды, у которой валентный угол Н–О–Н равен 104,5°.
Талица 1.
Валентные углы в молекулах гидридов элементов IV–VIA-групп
|
IVA-группа |
VA-группа |
VIA-группа | ||||
|
Формула |
Валентный угол,° |
Формула |
Валентный угол,° |
Формула |
Валентный угол,° | |
|
СН4 |
109,5 |
NH3 |
107,78 |
H2О |
104,5 | |
|
SiH4 |
РН3 |
93,3 |
H2S |
92,2 | ||
|
GeH4 |
AsH3 |
91,5 |
H2Se |
91,0 | ||
|
SnH4 |
SbH3 |
91,3 |
H2Te |
88,5 | ||
Из рис. 6 б видно, что близки к 90° и углы в молекулах гидридов элементов VA-группы (РН3, AsH3, SbH3), что хорошо согласуется с взаимным расположением трёх р-орбиталей, содержащих по одному электрону. Исключение составляет молекула аммиака, у которой валентные углы H–N–H равны 107,78° (табл. 1).
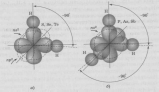
Рис. 6. Схема перекрывания аомных рбиталей в молекулах гидридов серы, селена, теллура (а), фосфора, мышьяка и сурьмы (б); пунктирными линиями изображены атомные ns- и пр-орбитали, на которых находятся не связывающие электронные пары
Труднее объяснить с позиций метода валентных связей геометрию молекул гидридов элементов IVA-группы. Атомы этих элементов в возбуждённом состоянии имеют четыре неспаренных электрона: один на s-орбитали и три на р-орбиталях. В гидридах СН4, SiH4, GeH4, SnH4 имеется четыре ковалентные связи. Три из них образованы за счёт перекрывания р-орбиталей атомов элементов IVA-группы и s-орбиталей атомов водорода. Эти связи должны иметь равную длину и энергию и располагаться под углом 90° друг к другу. Образование четвёртой ковалентной связи могло осуществиться за счёт перекрывания s-орбиталей атомов углерода и водорода, и она должна была бы отличаться от других связей по длине и энергии и располагаться по отношению к любой из них под углом около 125°. Однако установлено, что структура молекул гидридов элементов IVA-группы имеет форму тетраэдра с углами между связями, равными 109,5°, и при этом все ковалентные связи равноценны по длине и энергии.
Таким образом, геометрию молекул гидридов элементов IVA-группы (воды, аммиака и других веществ) невозможно объяснить с позиций только положений метода валентных связей.
Для объяснения пространственного строения молекул или многоатомных ионов с учётом направленности ковалентных связей Л. Полинг предложил концепцию гибридизации атомных орбиталей.
