- •Химическая связь
- •Астрахань
- •1. Ковалентная связь
- •1.1. Молекулярные орбитали1
- •1.2. Механизмы образования ковалентной связи
- •1.3. Особенности ковалентной связи
- •Кратность
- •Насыщаемость
- •Направленность
- •Гибридизация атомных орбиталей
- •Полярность
- •Поляризуемость
- •2. Ионная связь
- •3. Металлическая связь
- •4. Водородная связь
- •Вопросы для самоконтроля
1. Ковалентная связь
Слово "ковалентная" буквально означает "объединённая".
Ковалентная связь является наиболее универсальным типом химической связи. Она осуществляется в подавляющем большинстве веществ.
Химическая связь, осуществляемая за счёт одной или нескольких электронных пар, сильно взаимодействующих с ядрами обоих соединяемых атомов, называется ковалентной связью.
Идея об образовании химической связи с помощью пары электронов, принадлежащих обоим соединяемым атомам, была высказана в 1916 г. американским учёным Дж. Льюисом.
Ковалентная связь образуется между атомами, электроотрицательности которых одинаковы или различаются на небольшую величину. Например, в молекулах H2, F2, HF, СН4 (метан), С2Н6 (этан), С2Н4 (этилен), С2Н2 (ацетилен), СО2, H2S, H2O, SO2, NН3, S8 или в кристаллах алмаза, кремния и его карбида SiC.
1.1. Молекулярные орбитали1
При образовании ковалентной связи за счёт перекрывания электронных орбиталей взаимодействующих атомов (АО) возникает молекулярная орбиталь (МО). Отличие молекулярной орбитали от атомной заключается в том, что она охватывает ядра обоих соединяемых атомов. Как и на атомной орбитали, на молекулярной орбитали (согласно принципу Паули) может находиться 1 электрон или 2 электрона с противоположными спинами (↑↓). В ковалентной связи электронная плотность между ядрами соединяемых атомов значительна, что является следствием сильного взаимодействия общей электронной пары с ядрами обоих атомов.
В зависимости от характера распределения электронной плотности различают σ- и π- молекулярные орбитали.
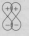
Молекулярная орбиталь, в которой максимальная электронная плотность сосредоточена на прямой, соединяющей ядра атомов, называется σ-молекулярной орбиталью (σ-МО).
σ-Молекулярная орбиталь образуется при перекрывании двух s-атомных орбиталей (молекула H2), s- и р-орбиталей (молекула HF) или двух р-орбиталей (молекула F2). Если ковалентная связь образуется с участием гибридных орбиталей (связи С–Н и С–С в молекуле этана CH3CH3), то также возникает σ-молекулярная орбиталь.
Ковалентная связь, при которой движение общей электронной пары описывается σ-молекулярной орбиталью, называется σ-связью.
Между двумя атомами может быть только одна σ-связь.
Варианты перекрывания атомных орбиталей, приводящие к образованию σ-связи:
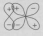
Молекулярная орбиталь, (которая возникает) возникающая в результате бокового перекрывания орбиталей взаимодействующих атомов, так, что её максимальная электронная плотность сосредоточена в плоскости, перпендикулярной оси, соединяющей ядра этих атомов, называется π-молекулярной орбиталью (π-МО).
Ковалентная связь, при которой движение электронной пары описывается π-молеклярной орбиталью, называется π-связью.
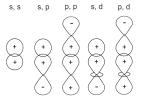
Варианты перекрывания атомных орбиталей, приводящие к образованию π-связи:
|
p, p |
p, d |
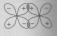
d, d |
|
|
|
|
Таким образом, s-орбитали участвуют в образовании только σ-связи, р-орбитали – σ- и π-связей; d-орбитали могут участвовать в образовании σ-, π-, а так же δ-связей. В последнем случае d-орбитали, расположенные в параллельных плоскостях, перекрываются всеми четырьмя лопастями.
Образование π-связи между атомами происходит в том случае, если они соединены σ-связью.
Например, в молекуле этилена H2C=CH2 (рис. 4):
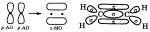
Рис. 4. Образование π-молекулярной орбитали в молекуле этилена.
Между атомами совместно с σ-связью могут быть одна или две π-связи:
>С=С<,>С=О, −N=N−, −С≡С−, −C≡N,N≡N
Реакционная способность π-связи больше, чем σ-связи, так как общая электронная пара, находящаяся на π-молекулярной орбитали, из-за большого удаления от ядер соединяемых атомов слабее взаимодействует с ними, чем в случае σ-молекулярной орбитали.
Между σ- и π-связями имеется существенное различие. Оно заключается в том, что вокруг σ-связи возможно практически свободное осевое вращение (рис. 5а). Напротив, вращение вокруг π-связи невозможно, так как каждая π-связь имеет две области перекрывания, и осевое вращение привело бы к отсутствию перекрывания и, следовательно, π-связи (рис. 5б).
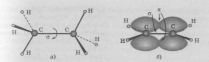
Рис. 5. Свободное вращение вокруг оси σ-связи в молекуле этана (а) и невозможность вращения вокруг оси π-связи в молекуле этилена (б)