
- •Химическая связь
- •Астрахань
- •1. Ковалентная связь
- •1.1. Молекулярные орбитали1
- •1.2. Механизмы образования ковалентной связи
- •1.3. Особенности ковалентной связи
- •Кратность
- •Насыщаемость
- •Направленность
- •Гибридизация атомных орбиталей
- •Полярность
- •Поляризуемость
- •2. Ионная связь
- •3. Металлическая связь
- •4. Водородная связь
- •Вопросы для самоконтроля
АСТРАХАНСКИЙ ГОСУДАРСТВЕННЫЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ

Рябухин Ю.И.
Химическая связь
Учебное пособие
Астрахань
2013
УДК 546
ББК
Р98
Химическая связь: Учебное пособие / Рябухин Ю. И. – Астрахань: Астрахан. гос. техн. ун-т, 2013. – 40 с.
Предназначено для студентов инженерно-технических нехимических специальностей.
Соответствует государственным образовательным стандартам высшего профессионального образования
Ил.: 15 рис., табл.: 1, библиография: 6 назв., прилож.
Печатается по решению кафедры «Общая, неорганическая и аналитическая химия» (протокол №__ от _________ 2013 г.)
Рецензент: канд. хим. наук, доцент Лебедева А.П.
© Рябухин Ю.И., 2013
© АГТУ, 2013
ВВЕДЕНИЕ
В природе химические элементы в виде свободных атомов (за исключением благородных газов – элементов VIIIА-группы) практически не встречаются. Обычно атомы какого-либо химического элемента взаимодействуют либо друг с другом, либо с атомами других элементов, образуя химические связи с возникновением соответственно простых или сложных веществ. В то же время и молекулы разных веществ взаимодействуют друг с другом.
Учение о химической связи составляет основу всей теоретической химии.
Химическая связь1– это совокупность сил, связывающих атомы друг с другом в более устойчивые структуры – молекулы или кристаллы.
Образование молекул и кристаллов обусловлено главным образом кулоновским притяжением между электронами и атомными ядрами.
Природа химической связи была уяснена лишь после открытия законов квантовой (волновой) механики, управляющих микромиром. Современная теория отвечает на вопросы, почему возникает химическая связь и какова природа её сил.
Образование химических связей — процесс самопроизвольный; в противном случае не существовало бы ни простых, ни сложных веществ. С термодинамической точки зрения причиной образования химической связи является уменьшение энергии системы.
Образование химической связи сопровождается выделением энергии, а её разрыв требует затраты энергии.
Характеристиками химической связи являются её энергия и длина.
Энергия химической связи — это энергия, выделяющаяся в процессе её образования и характеризующая её прочность; энергию связи выражают в кДж на моль образовавшегося вещества (Есв, кДж/моль)2.
Чем больше энергия химической связи, тем связь прочнее. Энергию химической связи двухатомной молекулы оценивают, сравнивая с состоянием, предшествующим её образованию. Для многоатомных молекул с одинаковым типом связи рассчитывают среднюю энергию химической связи (например, для Н2О или СН4).
Средняя энергия химической связи определяется делением энергии образования молекулы на число её связей.
Длиной химической связи называют расстояние между ядрами атомов в молекуле.
Длина связи обусловлена размерами связывающихся атомов и степенью перекрывания их электронных оболочек.
Например для фтороводорода и иодоводорода:
lHF < lHI
В зависимости от типа соединяемых частиц (атомов или молекул) различают внутримолекулярные связи, за счёт которых образуются молекулы, и межмолекулярные связи, приводящие к образованию ассоциатов из молекул или к связыванию атомов отдельных функциональных групп в молекуле. Эти виды связей резко отличаются по величине энергии: для внутримолекулярных связей энергия составляет 100–1000 кДж/моль1, а для межмолекулярных связей она обычно не превышает 40 кДж/моль.
Рассмотрим образование внутримолекулярной химической связи на примере взаимодействия атомов водорода.
При сближении двух атомов водорода между их электронами с антипараллельными спинами происходит сильное обменное взаимодействие, приводящее к появлению общей электронной пары. При этом увеличивается электронная плотность в межъядерном пространстве, что способствует притяжению ядер, взаимодействующих атомов. В результате энергия системы уменьшается и система становится более устойчивой - между атомами возникает химическая связь (рис. 1).
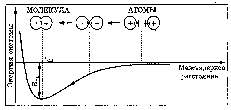
Рис. 1. Энергетическая диаграмма образования химической связи между атомами водорода
Система имеет минимум энергии при определённом расстоянии между ядрами атомов; при дальнейшем сближении атомов энергия увеличивается вследствие возрастания сил отталкивания между ядрами.
В зависимости от того, каким образом взаимодействует общая электронная пара с ядрами соединяемых атомов, различают три основных типа химической связи: ковалентную, ионную и металлическую, а также водородную связь.
