
- •Химическая связь
- •Астрахань
- •1. Ковалентная связь
- •1.1. Молекулярные орбитали1
- •1.2. Механизмы образования ковалентной связи
- •1.3. Особенности ковалентной связи
- •Кратность
- •Насыщаемость
- •Направленность
- •Гибридизация атомных орбиталей
- •Полярность
- •Поляризуемость
- •2. Ионная связь
- •3. Металлическая связь
- •4. Водородная связь
- •Вопросы для самоконтроля
1.2. Механизмы образования ковалентной связи
Ковалентная связь, в зависимости от того, как возникает общая электронная пара, может образовываться по обменному или донорно-акцепторному механизму.
Обменный механизм реализуется в тех случаях, когда в возникновении общей электронной пары от каждого соединяемого атома участвуют и атомная орбиталь, и электрон, находящийся на этой орбитали.
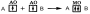
Например, при образовании молекулы водорода атомы, содержащие на s-орбиталях одиночные электроны с противоположными спинами, образуют общую электронную пару, движение которой описывается σ-молекулярной орбиталью, возникающей при перекрывании двух s-атомных орбиталей:
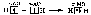

При образовании молекулы аммиака атом азота, имея на четырёх гибридных орбиталях внешнего энергетического уровня три одиночных электрона и одну электронную пару, образует с электронами трёх атомов водорода три общие электронные пары, движение которых описываются тремя σ-молекулярными орбиталями, каждая из которых возникает при слиянии трёх орбиталей атома азота с s-орбиталями трёх атомов водорода:
Таким образом, в молекуле аммиака атом азота связан тремя σ- связями с атомами водорода и имеет неподелённую электронную пару.
Донорно-акцепторный механизм образования ковалентной связи реализуется в тех случаях, когда электронейтральный атом или отрицательно заряженный ион (донор) имеет электронную пару на орбитали внешнего энергетического уровня, а другой нейтральный атом или положительно заряженный ион (акцептор) — свободную (вакантную) орбиталь. При перекрывании атомных орбиталей возникает молекулярная орбиталь, на которой находится общая электронная пара, ранее принадлежавшая атому-донору:
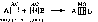
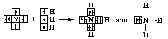
По донорно-акцепторному механизму происходит, например, образование ковалентной связи между молекулой аммиака и ионом водорода с возникновением иона аммония [NH4]+. В молекуле аммиака у атома азота на орбитали внешнего энергетического уровня имеется электронная пара, что позволяет этому атому выступать в роли донора. У положительно заряженного атома водорода (акцептора) имеется свободная s-орбиталь. За счёт перекрывания орбиталей атомов азота и водорода возникает σ-молекулярная орбиталь, а свободная электронная пара атома азота становится общей для соединяемых атомов:
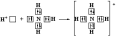
или

В ионе аммония [NH4]+ ковалентная связь N—H, образовавшаяся по донорно-акцепторному механизму, равноценна (по энергии и длине) трём другим связям N—H, образовавшимся по обменному механизму.
Атом бора образует молекулу фторида бора BF3 за счёт перекрывания трёх из четырех орбиталей, занятых в возбуждённом состоянии неспаренными электронами, с электронными орбиталями фтора. При этом у атома бора остаётся вакантная орбиталь, за счет которой (как акцептора) может образоваться четвёртая ковалентная связь с фторид - ионом (донором).
BF3 + F- → [BF4]-
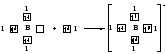
Связь, образованную по донорно-акцепторному механизму, часто называют донорно-акцепторной, координационной или координативной. Однако это не особый тип связи, а лишь иной механизм образования ковалентной связи.
Донорно-акцепторный механизм образования ковалентной связи характерен для комплексных (координационных) соединений: роль акцептора обычно выполняют атомы d-металлов, которые могут предоставлять две, четыре или шесть свободных атомных орбиталей s-, p-, d-типа, что расширяет их возможности образовывать ковалентные связи.
Например, атомы (ионы) Ag+ и Сu2+ как акцепторы соответственно предоставляют две и четыре свободные орбитали, а донором электронных пар могут быть, например, молекулы аммиака или цианид - иона:
Акцептор Донор
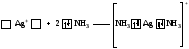
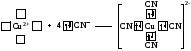
В данных случаях между донорами и акцептором возникают ковалентные связи с образованием комплексных катиона (аммиаката серебра) или аниона (тетрацианида меди).
