
- •ХИМИЧЕСКАЯ
- •Химическая связь - это различные виды взаимодействия, обуславливающие устойчивое существование двух- и многоатомных
- •Основные черты химической связи:
- •Ковалентная связь.
- •По закону Гесса то же количество выделится при взаимодействии двух атомов водорода.
- •Взаимодействие атомов водорода происходит или на стенках сосуда или в присутствии других молекул,
- •Поэтому добавление инертных газов ускоряет процесс:
- •Объединяются атомы только с противоположными спинами.
- •Проникновение электронных облаков взаимодействующих атомов друг в друга – это
- •Изменение потенциальной энергии Е системы из двух атомов Н в зависимости от расстояния
- •Льюис предположил: устойчивые внешние электронные конфигурации у молекул могут возникнуть в результате обобществления
- •Правило октета: стремление к созданию устойчивой электронной конфигурации благородного газа (2-х или 8-и
- •Энергия и длина связи
- •С уменьшением длины связи энергия связи растёт и соответственно, устойчивость молекул увеличивается.
- •Метод валентных связей (ВС)
- •3)В соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с
- •При сближении атомов с антипараллельными спинами происходит уменьшение энергии системы, т.к. увеличивается электронная
- •В образовании химической связи участвуют электроны внешней оболочки.
- •В рассмотренных соединениях используется правило октета.
- •При образовании связи изменения претерпевает электронная структура внешних оболочек и подоболочек атомов.
- •Механизм образования ковалентной связи
- •Образование молекулы Н2О
- •2) Донорно-акцепторный механизм:
- •Характеристики ковалентной связи
- •Способность атома перетягивать на себя область перекрывания электронных облаков зависит от способности одного
- •Два атома А и В образуют молекулу АВ. Т.к. атомы разные, то связь
- •В сумме энергетические изменения составляет:
- •Неравенство можно переписать в виде:
- •Электроотрицательность позволяет сравнивать атомы по их способности оттягивать электронную плотность при образовании химической
- •Электрический момент диполя м - равен векторной сумме электрических моментов диполей связей, имеющихся
- •Дипольный момент, приходящийся на связь, рассматривают как вектор. При этом надо учитывать вклад
- •Дипольный момент многоатомной молекулы можно считать равным векторной сумме дипольных моментов всех связей
- •Синтезировали дихлорбензол С6Н4С12 с дипольным
- •Необходимо учитывать природу многоатомных заместителей в молекуле.
- •Эффективные заряды.
- •Значения эффективных зарядов в подгруппе уменьшаются, например:
- •Поляризуемость, ( ) - способность молекулы становиться полярной (или более полярной) под действием
- •Насыщаемость.
- •Валентность - число связей, которые данный атом может образовать с другими атомами.
- •Например, углерод в основном состоянии имеет структуру:
- •При возбуждении атома – происходит разъединение 2s электронов и переход одного из них
- •Суммарная валентность равна числу неспаренных электронов (обменный механизм) плюс число связей, образованных по
- •Направленность.
- •Может возникать при перекрывании орбиталей s - s, р - р, d-d-типа, а
- •Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра – боковое перекрывание
- •Число связей между атомами называется
- •Строение бензола является промежуточным между:
- •Для более точного решения вводятся ещё 3 структуры:
- •Гибридизация атомных орбиталей
- •Гибридизация – это изменение формы атомной орбитали за счет комбинации с другими атомными
- •Волновая функция гибридной орбитали:
- •Условия устойчивости гибридизации:
- •Виды гибридизации
- •sр2- составлены из одной s и двух р - орбиталей, всего их 3.
- •sp3 - составлены из одной s и трёх р - орбиталей, всего их
- •Пространственная структура молекул
- •Состояние sp3-гибридизации - угловая структура
- •Четырехатомные молекулы имеют два типа структур
- •Тяжелые элементы, из-за рыхлой структуры электронных оболочек связи чаще образуются чистыми p- и
- •В молекулах СН4, NН3, Н2О углерод, азот и кислород имеют sp3 тип гибридизации,
- •Гибридизация с участием d – орбиталей
- •Недостатки метода валентных связей
- •Атом кислорода имеет два неспаренных электрона.
- •Метод молекулярных орбиталей (МО)
- •3)В результате атомные орбитали трансформируются в молекулярные.
- •Молекулярная орбиталь (МО) – волновая функция, которая описывает состояние электрона в поле двух
- •Метод ЛКАО
- •Перекрывание атомных орбиталей а и в соответствует сложению электронных плотностей, и возникает молекулярная
- •Если спины электронов атомных орбиталей параллельны, то эти электроны отталкиваются, и электронные плотности
- •При сложении, электронная плотность в области между ядрами возрастает и образуется связь, энергия
- •При вычитании электронная плотность между ядрами равна нулю, атомы расталкиваются и энергия системы
- •Образование связывающей и разрыхляющей молекулярной орбитали из атомных s-орбиталей.
- •МО, получающиеся при комбинации s атомных орбиталей называются σs МО.
- •При комбинации 2рх атомный орбиталей образуются две σх МО (где х – линия,
- •При комбинации двух ру и двух рz атомных орбиталей образуются две πу и
- •У связывающих МО электронная плотность сосредоточена между ядрами, это снижает запас энергии и
- •р(х) связывание сильнее р(у) ир(z) связывания, поэтому энергетический уровень молекулярной орбитали св2р(х) должен
- •Поэтому уровень св2р(х) перемещен несколько выше уровнейсвр(у) и свр(z), т.к. при образовании двухатомной
- •Порядок заполнения МО
- •Кулоновские интегралы – это энергия, необходимая для отрыва электрона с данной атомной орбитали
- •Второй электрон поступит на ту же орбиталь и образуется нейтральная молекула водорода Н2.
- •Молекула Не2 должна была бы содержать 4 электрона – два связывающих и два
- •Схема образования молекулярных орбиталей у двухатомных молекул второго периода
- •По мере заполнения связывающих МО прочность связи повышается: увеличивается её порядок, уменьшается длина
- •Если два электрона находятся на одной орбитали, то их магнитные поля замыкаются.
- •Для разноименных атомов учитывается I.
- •Построение МО для молекул с гибридизацией
- •Достоинства метода МО:
- •Общие черты ММО и МВС
- •Ионная связь
- •Атомы, отдавшие часть электронов, приобретают положительный заряд и становятся положительно заряженными ионами –
- •Схема образования NaC1
- •Связь, которая образуется за счёт электростатического взаимодействия разнополярных ионов называется ионной.
- •Энергия ионной связи
- •Ионная связь, характеризуется:
- •Поляризация иона - это относительное смещение ядра и окружающих его электронов внешней электронной
- •Различают поляризуемость и поляризующую силу.
- •Поляризующая сила иона – это способность деформировать, поляризовать другой ион.
- •Изменение радиуса
- •Поляризация ионов влияет на свойства соединений:
- •Металлическая связь
- •Металлическая связь – это связь, в которой электрон каждого отдельного атома принадлежит всем
- •Межмолекулярные взаимодейсвия Ван-дер-ваальсовы силы.
- •Индукционное взаимодействие
- •Дисперсионное взаимодействие
- •Молекула
- •Ван-дер-ваальсовы силы действуют между молекулами лишь при близком расположении.
- •Донорно-акцепторное взаимодействие
- •Водородная связь
- •Если водородная связь образуется между разными молекулами, то она называется межмолекулярной.
Поляризация иона - это относительное смещение ядра и окружающих его электронов внешней электронной оболочки под действием электрического поля соседнего иона.
Электроны смещаются в сторону катионов.
При сближении ионов происходит смещение электронов по отношению к ядру и возникает индуцированный дипольный момент индуц.
Различают поляризуемость и поляризующую силу.
Поляризуемость ионов - это их способность деформироваться под действием внешнего электрического поля.
Коэффициент поляризуемости равен: r3. Особенности поляризуемости:
1.Возрастает с ростом первого квантового числа n (число электронных слоев).
2.Поляризуемость анионов больше поляризуемости катионов того же электронного слоя.
3.Поляризуемость ионов возрастает с уменьшением силового поля (с уменьшением заряда и увеличением радиуса атома).
Рост заряда приводит к уменьшению радиуса иона и упрочнению связи электронов с ядром.
Поляризующая сила иона – это способность деформировать, поляризовать другой ион.
Особенности поляризующей силы:
1.Уменьшается с возрастанием радиуса иона и уменьшением заряда иона.
2.Поляризующая сила катионов больше, чем у анионов.
3.Катионы со структурой благородного газа обладают меньшей поляризующей силой, чем катионы с 18-электронной оболочкой (получены из d-элементов).
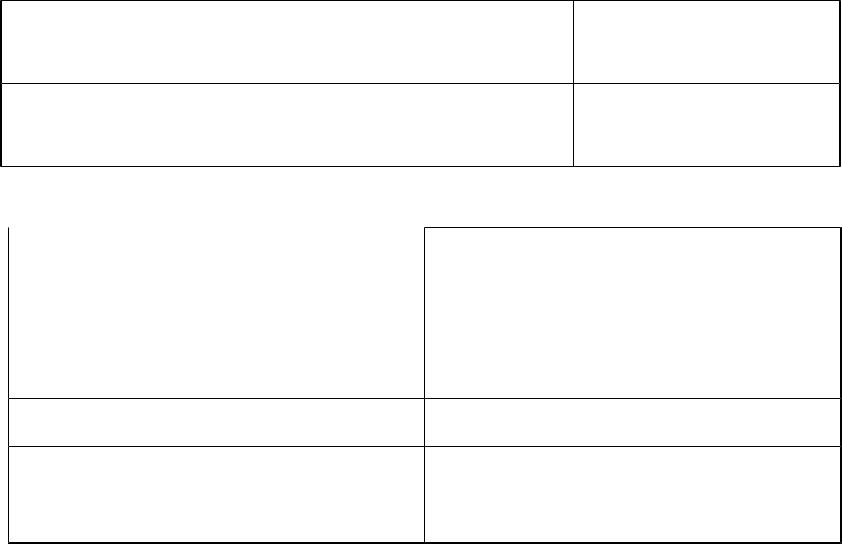
Изменение радиуса |
Поляризуемость |
Поляризующая |
|
(подвергаться) |
сила (подвергать) |
Увеличение радиуса |
увеличивается |
уменьшается |
катиона или аниона |
|
|
Поляризационные свойства катионов одинакового заряда и |
||||
радиуса увеличиваются в ряду: |
|
|
||
|
катионы |
с |
катионы с |
катионы с 18 |
|
благородно- |
|
незакончен- |
электронной |
|
газовой |
|
ным |
оболочкой |
|
оболочкой |
|
внешним |
|
|
|
|
уровнем |
|
катион |
Mg2+ |
|
Ni2+ |
Zn2+ |
Радиус, нм |
0,078 |
|
0,079 |
0,083 |
Оболочка |
2S22Р6 |
|
3S23Р63d8 |
3S23Р63d10 |
Для анионов поляризационные свойства ухудшаются в ряду: I-, Br-, C1-, CN-, OH-, NO3-, F-, C1O4-.
Поляризация ионов влияет на свойства соединений:
1)понижает температуры кипения и плавления,
2) уменьшает электролитическую диссоциацию в растворах и расплавах.
3)увеличивает прочность связи.
4)Увеличение поляризации и поляризующего действия ионов усиливает окраску вещества. Например, РbI2 окрашен, СаI2 бесцветен, т.к. у
Рb2+ больше поляризующее действие, чем у Са2+.
Металлическая связь
Отличие свойств металлов от других веществ:
1) высокая электрическая проводимость и теплопроводность, следовательно часть электронов может передвигаться по всему объёму куска металла.
2)в обычных условиях они кристаллические вещества (исключение ртуть) с высокими координационными числами атомов, следовательно их атомы не связаны друг с другом локализованными двухэлектронными связями .
3)невысокая энергия ионизации, т.к. валентные электроны легко перемещаются по всему кристаллу.

Металлическая связь – это связь, в которой электрон каждого отдельного атома принадлежит всем атомам находящимся в контакте.
В металле небольшое число электронов одновременно связывает большое число атомных ядер, а сами электроны могут перемещаться в металле, т.е. существует сильно делокализованная химическая связь.
Например: Для образования кристалла лития каждый атом предоставляет на связь 4 валентных орбитали и всего лишь 1 валентный электрон. Число электронов значительно меньше числа орбиталей, поэтому электроны принимают участие в образовании связи между всеми атомами кристалла металла.

Межмолекулярные взаимодейсвия Ван-дер-ваальсовы силы.
Емм = Еор + Еинд + Едисп
Диполь-дипольное взаимодействие (ориентационное Еор)
μ – постоянный электрический момент диполя молекулы,
r – расстояние между центрами диполей.
Еор возрастает с увеличением электрического момента диполя молекул и уменьшается с ростом температуры, так как тепловое движение нарушает ориентацию молекул.

Индукционное взаимодействие
Е инд. = -2αμ2/r6.
Индукционное взаимодействие увеличивается с увеличением момента диполя, поляризуемости и размера молекулы.
Еинд.< Еор.

Дисперсионное взаимодействие
hν0/2–энергия колебаний атомов при 0К
Полная энергия межмолекулярного взаимодействия
а и b постоянные, lв – расстояние между молекулами
