
- •ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ.
- •Водородный показатель (рН) – это отрицательный десятичный логарифм от концентрации ионов водорода в
- •Для слабых электролитов:
- •Для сильных электролитов нужно учитывать ионную связь.
- •Кислотно-основные индикаторы.
- •Буферные растворы
- •Уравнения Гендерсона—Хассельбаха
- •Буферная емкость - это число моль - эквивалентов сильной кислоты или сильного основания,
- •Приготовление буферных растворов.
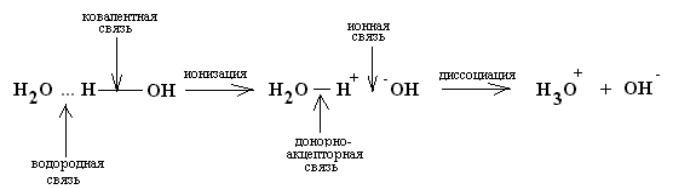
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ.
Это самоионизацией или автопротолизом.
В более простом виде Н2О↔Н+ +ОН-.
Кд = аН+*аОН-/аН2О
[Н+]*[ОН-]=Кд*[Н2О]=Кв– ионное произведение воды
Кв= 10-14 при 295 К [Н+]=[ОН-] = √Кв = 10-7моль/л.
Пример В растворе НNО3 с См=0,01 моль/л [Н+] равна концентрации растворенных молекул НNО3, т.е. [Н+]=10-2 моль/л.
Тогда [ОН-] = 10-14/10-2 = 10-12 моль/л. Для нейтрального раствора:
[Н+]=[ОН-]=10-7 моль/л. Для кислых растворов:
[Н+] > 10-7, а [ОН-]<10-7. Для основных растворов
[Н+] <10-7, а [ОН-]>10-7.
Водородный показатель (рН) – это отрицательный десятичный логарифм от концентрации ионов водорода в растворе.
рН = - lg аН+ |
рН = -lg [Н+] |
Гидроксильный показатель (рОН) – это отрицательный десятичный логарифм от концентрации гидроксид - ионов в растворе.
рОН = - lg[ОН-] |
рОН = - lg аОН- |
рН+рОН=14 рОН=14-рН
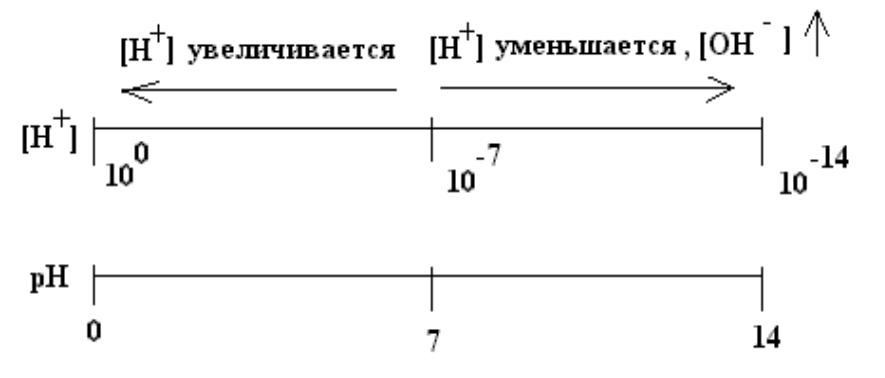
Для кислых растворов рН<7. Для основных растворов рН>7.
Для нейтральных растворов рН=7.
Для слабых электролитов:
аН+≈[Н+] |
рН≈-1g[Н+]. |
[Н+] = α*с = √Кд*с |
[ОН-] = √Кд*с. |
Пример Определить концентрацию ионов ОН- в 0,01М растворе NН4ОН. Рассчитать рН раствора.
NН4ОН ↔ NН4+ + ОН-; α = √Кд/ с.
α = √1,8*10-5/0,01 = √18*10-4 = 4,24*10-2. [ОН-] = α*с = 4,24*10-2*0,01 = 4,24*10-4моль/л. рОН = -lg[ОН-] = -lg4,24*10-4 = 3,34.
рН = рКв –рОН = 14 –3,34 = 10,63 – щелочная среда
Для сильных электролитов нужно учитывать ионную связь.
Пример Рассчитать рН раствора, содержащего 0,01 моль/л НС1 и 0,01 моль/л СаС12.
НС1 и СаС12 сильные электролиты, то они диссоциируют полностью:
НС1 ↔ Н+ + С1- СаС12 ↔ Са2+ + 2С1- рН = -lg аН+ = - lgfН+*[Н+]
I = ½Σсi z = ½(сСа2+*z2Са2++сС1-*z2С1-+сН+*z2Н+) =
½(0,01*22+(0,02+0,01)*12+0,01*12)=0,04.
При I=0,04 fН+=0,86, тогда рН = -lg(0,86*0,01) = 2,07. Для слабой кислоты: рН = ½ (рКдисс к-ты – lgCм к-ты) Для оснований: рН = 14 + ½ (lgСм осн – рКдисс. осн.)
Кислотно-основные индикаторы.
Индикаторы - слабые органические кислоты Нind или основания IndОН, молекулы и ионы которых имеют разную окраску.
Нind ↔ Н+ + Ind- IndOH ↔ Ind+ + ОН-
аInd->аHind, при Кд>аН+ - окраска иона. аInd-<аHind, при Кд<аН+ - окраска молекулы. аInd-=аHind, при Кд=аН+ идет смена окраски.
Буферные растворы
Растворы, рН которых относительно мало изменяется при добавлении небольших количеств кислоты или основания, называются буферными.
Содержат слабую кислоту (основание) и её (его) соль. Например: СН3СООН+СН3СООК:
СН3СООН↔СН3СОО-+Н+ СН3СООК↔СН3СОО-+К+
Добавление кислоты: ионы Н+ связываются в слабую кислоту:
СН3СОО-+К++Н++С1-→СН3СООН+К++С1-, рН не меняется.
Добавление основания: ионы ОН- связываются в слабый электролит Н2О:
СН3СООН+К++ОН-→СН3СОО- +К++Н2О, рН не меняется.
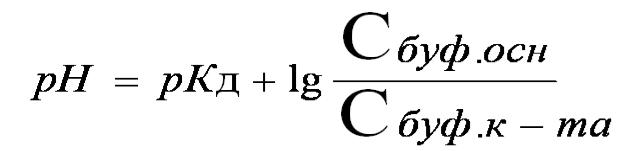
Уравнения Гендерсона—Хассельбаха
Не используется:
1)для кислот с Кд выше - 10-3, т.к. в этом случае нельзя пренебрегать диссоциацией;
2)для кислот с Кд меньше - 10-11, т. к. в этом случае нельзя пренебрегать гидролизом соли; 3)если концентрации компонентов буферной системы отличаются более чем в 100 раз;
4)когда концентрация кислоты или ее соли очень мала, ниже 10 -6М
Биологические буферные системы: гидрокарбонатная (рКд=6,10; Кд=7,95*10-8) гидрофосфатная (рКд = 6,82; Кд = 1,5*10-7) гемоглобиновая (рКд = 8,20; Кд =6,3*10-9)
Буферные растворы, используемые в клиническом анализе:
ацетатный (рКд =4,76; Кд =1,74*10-5) фосфатный (рКд =7,21; Кд =6,2*10-8)
цитратные ( pKд1 = 3,13; Kд1 = 7,4 *10-4, рКд2=4,66; Кд2=2,2 *10-5)
глициновые (pKд1=2,35; Kд1 = 4,5*10-3, рКд2=9,77; Кд2=1,7*10-10)
