
- •ХИМИЧЕСКАЯ
- •Химическая связь - это различные виды взаимодействия, обуславливающие устойчивое существование двух- и многоатомных
- •Основные черты химической связи:
- •Ковалентная связь.
- •По закону Гесса то же количество выделится при взаимодействии двух атомов водорода.
- •Взаимодействие атомов водорода происходит или на стенках сосуда или в присутствии других молекул,
- •Поэтому добавление инертных газов ускоряет процесс:
- •Объединяются атомы только с противоположными спинами.
- •Проникновение электронных облаков взаимодействующих атомов друг в друга – это
- •Изменение потенциальной энергии Е системы из двух атомов Н в зависимости от расстояния
- •Льюис предположил: устойчивые внешние электронные конфигурации у молекул могут возникнуть в результате обобществления
- •Правило октета: стремление к созданию устойчивой электронной конфигурации благородного газа (2-х или 8-и
- •Энергия и длина связи
- •С уменьшением длины связи энергия связи растёт и соответственно, устойчивость молекул увеличивается.
- •Метод валентных связей (ВС)
- •3)В соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с
- •При сближении атомов с антипараллельными спинами происходит уменьшение энергии системы, т.к. увеличивается электронная
- •В образовании химической связи участвуют электроны внешней оболочки.
- •В рассмотренных соединениях используется правило октета.
- •При образовании связи изменения претерпевает электронная структура внешних оболочек и подоболочек атомов.
- •Механизм образования ковалентной связи
- •Образование молекулы Н2О
- •2) Донорно-акцепторный механизм:
- •Характеристики ковалентной связи
- •Способность атома перетягивать на себя область перекрывания электронных облаков зависит от способности одного
- •Два атома А и В образуют молекулу АВ. Т.к. атомы разные, то связь
- •В сумме энергетические изменения составляет:
- •Неравенство можно переписать в виде:
- •Электроотрицательность позволяет сравнивать атомы по их способности оттягивать электронную плотность при образовании химической
- •Электрический момент диполя м - равен векторной сумме электрических моментов диполей связей, имеющихся
- •Дипольный момент, приходящийся на связь, рассматривают как вектор. При этом надо учитывать вклад
- •Дипольный момент многоатомной молекулы можно считать равным векторной сумме дипольных моментов всех связей
- •Синтезировали дихлорбензол С6Н4С12 с дипольным
- •Необходимо учитывать природу многоатомных заместителей в молекуле.
- •Эффективные заряды.
- •Значения эффективных зарядов в подгруппе уменьшаются, например:
- •Поляризуемость, ( ) - способность молекулы становиться полярной (или более полярной) под действием
- •Насыщаемость.
- •Валентность - число связей, которые данный атом может образовать с другими атомами.
- •Например, углерод в основном состоянии имеет структуру:
- •При возбуждении атома – происходит разъединение 2s электронов и переход одного из них
- •Суммарная валентность равна числу неспаренных электронов (обменный механизм) плюс число связей, образованных по
- •Направленность.
- •Может возникать при перекрывании орбиталей s - s, р - р, d-d-типа, а
- •Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра – боковое перекрывание
- •Число связей между атомами называется
- •Строение бензола является промежуточным между:
- •Для более точного решения вводятся ещё 3 структуры:
- •Гибридизация атомных орбиталей
- •Гибридизация – это изменение формы атомной орбитали за счет комбинации с другими атомными
- •Волновая функция гибридной орбитали:
- •Условия устойчивости гибридизации:
- •Виды гибридизации
- •sр2- составлены из одной s и двух р - орбиталей, всего их 3.
- •sp3 - составлены из одной s и трёх р - орбиталей, всего их
- •Пространственная структура молекул
- •Состояние sp3-гибридизации - угловая структура
- •Четырехатомные молекулы имеют два типа структур
- •Тяжелые элементы, из-за рыхлой структуры электронных оболочек связи чаще образуются чистыми p- и
- •В молекулах СН4, NН3, Н2О углерод, азот и кислород имеют sp3 тип гибридизации,
- •Гибридизация с участием d – орбиталей
- •Недостатки метода валентных связей
- •Атом кислорода имеет два неспаренных электрона.
- •Метод молекулярных орбиталей (МО)
- •3)В результате атомные орбитали трансформируются в молекулярные.
- •Молекулярная орбиталь (МО) – волновая функция, которая описывает состояние электрона в поле двух
- •Метод ЛКАО
- •Перекрывание атомных орбиталей а и в соответствует сложению электронных плотностей, и возникает молекулярная
- •Если спины электронов атомных орбиталей параллельны, то эти электроны отталкиваются, и электронные плотности
- •При сложении, электронная плотность в области между ядрами возрастает и образуется связь, энергия
- •При вычитании электронная плотность между ядрами равна нулю, атомы расталкиваются и энергия системы
- •Образование связывающей и разрыхляющей молекулярной орбитали из атомных s-орбиталей.
- •МО, получающиеся при комбинации s атомных орбиталей называются σs МО.
- •При комбинации 2рх атомный орбиталей образуются две σх МО (где х – линия,
- •При комбинации двух ру и двух рz атомных орбиталей образуются две πу и
- •У связывающих МО электронная плотность сосредоточена между ядрами, это снижает запас энергии и
- •р(х) связывание сильнее р(у) ир(z) связывания, поэтому энергетический уровень молекулярной орбитали св2р(х) должен
- •Поэтому уровень св2р(х) перемещен несколько выше уровнейсвр(у) и свр(z), т.к. при образовании двухатомной
- •Порядок заполнения МО
- •Кулоновские интегралы – это энергия, необходимая для отрыва электрона с данной атомной орбитали
- •Второй электрон поступит на ту же орбиталь и образуется нейтральная молекула водорода Н2.
- •Молекула Не2 должна была бы содержать 4 электрона – два связывающих и два
- •Схема образования молекулярных орбиталей у двухатомных молекул второго периода
- •По мере заполнения связывающих МО прочность связи повышается: увеличивается её порядок, уменьшается длина
- •Если два электрона находятся на одной орбитали, то их магнитные поля замыкаются.
- •Для разноименных атомов учитывается I.
- •Построение МО для молекул с гибридизацией
- •Достоинства метода МО:
- •Общие черты ММО и МВС
- •Ионная связь
- •Атомы, отдавшие часть электронов, приобретают положительный заряд и становятся положительно заряженными ионами –
- •Схема образования NaC1
- •Связь, которая образуется за счёт электростатического взаимодействия разнополярных ионов называется ионной.
- •Энергия ионной связи
- •Ионная связь, характеризуется:
- •Поляризация иона - это относительное смещение ядра и окружающих его электронов внешней электронной
- •Различают поляризуемость и поляризующую силу.
- •Поляризующая сила иона – это способность деформировать, поляризовать другой ион.
- •Изменение радиуса
- •Поляризация ионов влияет на свойства соединений:
- •Металлическая связь
- •Металлическая связь – это связь, в которой электрон каждого отдельного атома принадлежит всем
- •Межмолекулярные взаимодейсвия Ван-дер-ваальсовы силы.
- •Индукционное взаимодействие
- •Дисперсионное взаимодействие
- •Молекула
- •Ван-дер-ваальсовы силы действуют между молекулами лишь при близком расположении.
- •Донорно-акцепторное взаимодействие
- •Водородная связь
- •Если водородная связь образуется между разными молекулами, то она называется межмолекулярной.
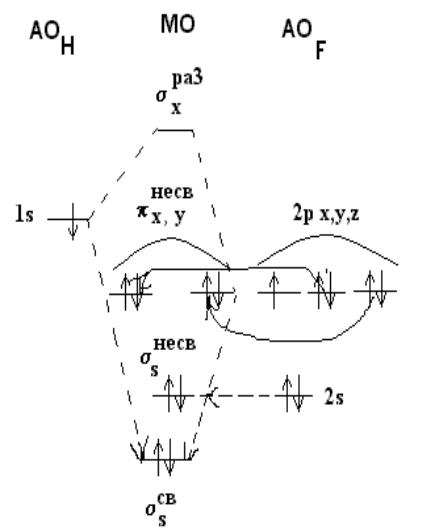
Для разноименных атомов учитывается I.
Чем выше I элемента, тем относительно ниже энергетические уровни, соответствующие АО.
Например, молекула НF.
IF >IH, 2р –орбитали F лежат ниже, чем1s – орбитали Н.
1s водорода и 2s фтора орбитали не комбинируются из-за разной энергии. Не комбинируются 2ру, 2рz орбитали
F и 1s орбиталь H – из-за их различной симметрии относительно оси связи. Т.о. 2s, 2ру, 2рz орбитали
фтора переносятся без изменения в молекулу НF, они - несвязывающие.
Тогда МОсв и МОраз образуется из 1s орбитали водорода и 2рх – орбитали
фтора

Построение МО для молекул с гибридизацией
В молекуле ВН3 углы равны 1200 и связи равноценны, т.е.
у В-sр2 – гибридизация.
2рz перпендикулярны плоскости молекулы и образуют несвязывающую орбиталь. .

Достоинства метода МО:
1)более универсален, позволяет объяснить возникновение, и характер связей у более широкого круга соединений;
2)с его помощью удается рассчитать параметры связей и соединений.
Недостатки метода МО:
1)более сложен;
2)менее нагляден;
3)не дает характеристику отдельных атомов в молекулах и фрагментах молекул.
Общие черты ММО и МВС
1)они дают одинаковое распределение электронной плотности в соединениях, которое можно объяснить по тому и другому методу.
2)Условием образования химической связи является перекрывание АО, причем прочность связи растет с увеличением электронной плотности между ядрами.
3)В зависимости от типа АО образуются σ-, π-, δ- связи.
Метод МО применяется для описания поведения делокализованных электронов.
Метод ВС лучше описывает поведение локализованных связей
Ионная связь
Теория ионной связи:
1)самой устойчивой электронной конфигурацией атома является, когда на внешнем электронном уровне находятся 8 или 2 электрона.
2)Довольно устойчивы также атомы, внешний слой которых содержит 18 электронов.
3)Во время химической реакции атомы стремятся приобрести наиболее устойчивую конфигурацию.
4)Это достигается в результате присоединения электронов атомов других элементов или отдачи электронов из внешнего слоя атомам.
5)Разноименные ионы удерживаются друг около друга силами электростатического притяжения.
Атомы, отдавшие часть электронов, приобретают положительный заряд и становятся положительно заряженными ионами – катионами.
Атомы, присоединившие электрон, превращаются в отрицательно заряженные ионы –
анионы.
Катионообразующие атомы: водород и металлы. Легче всего образуются одно- и двух зарядные катионы. Трех-, четырех- и более зарядные катионы фактически не существуют.
Анионы из простых веществ существуют только однозарядные, т.к. уже 2 дополнительных электрона ядро удержать в форме иона не в силах. Поэтому есть C1-, Br-, но О2-, S2- не существуют, в растворах всегда ОН-, SН-.
Схема образования NaC1
1)Электронная конфигурация натрия 1S22S22Р63S1.
Легко отдает 3S электрон, приобретая устойчивую конфигурацию из 8 электронов на внешнем уровне 2S22Р6
Na - е = Nа+, Еиониз.= 493 кДж/моль
2) Электронной конфигурации хлора 1S22S22Р63S23Р5. Легко присоединяет один электрон при этом возникает устойчивая конфигурация 3S23Р6.
С1 + е = С1-, Еср=365 кДж/моль
3) Образовавшиеся ионы натрия и хлора, притягиваются.
Na+ + С1- = Na+С1-.
Связь, которая образуется за счёт электростатического взаимодействия разнополярных ионов называется ионной.
Ионная связь является крайним случаем ковалентной связи.
Стопроцентной ионной связи не бывает, т.к. невозможно полное разделение зарядов, вследствие волновой природы электронов.
Энергия ионной связи
Сила притяжения между недеформированными заряженными шарами с зарядами е:
fпр = е/r2 r-расстояние между центрами ионов. Энергия притяжения: Uпр = -(е2/r).
При увеличении радиуса, энергия притяжения уменьшается.
Энергия отталкивания: Uотт=В/rn.
N – коэффициент борновского отталкивания.
При увеличении радиуса энергия отталкивания уменьшается.
На равновесном расстоянии r0:Uотт=Uпр.

Ионная связь, характеризуется:
1)ненаправленностью, т.к. ионы можно представить, как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве.
2)ненасыщаемостью, т.к. при взаимодействии ионов противоположного знака не может привести к полной нейтрализации зарядов.
Вокруг положительного иона всегда группируются не 1, а несколько отрицательных зарядов, точное число которых меняется.
