
химия лабораторный практикум
.pdf
|
|
|
|
|
|
|
|
|
70 |
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
Время, мин. |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
д |
|
|
|
|
|
|
|
|
||
|
|
Рис. 7. Кривые охлаждения сплава Bi – Sn |
|
|||||||||||||||||
t, 0C |
|
|
|
|
|
|
|
t,0C |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
- |
|
|
Cd 100% |
- |
|
|
|
|
|
Cd 70% |
|
|||||||||
400 |
|
|
|
|
|
|
|
|
400 |
|
|
|
|
|
|
Se 30% |
|
|||
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
||
300 |
|
|
|
|
|
|
|
|
300 – |
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
||
200 |
|
|
|
|
|
|
|
|
200 – |
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
100 |
|
|
|
|
|
|
|
|
100 – |
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
||
0 |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
Время, мин |
|
|
|
Время, мин |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
а |
|
|
|
|
|
|
|
б |
|
|||||||
t,0C |
|
|
|
|
|
|
|
t, 0C |
|
|
|
|
|
|
|
|
||||
- |
|
|
|
Cd 41% |
- |
|
|
|
Cd 18% |
|
||||||||||
400 – |
|
|
|
Se 59% |
400 – |
|
|
|
Se 82% |
|
||||||||||
- |
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
||
300 – |
|
|
|
|
|
|
|
|
300 – |
|
|
|
|
|
|
|
|
|||
- |
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
||
200 |
|
|
|
|
|
|
|
|
200 – |
|
|
|
|
|
|
|
|
|||
- |
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
||
100 |
|
|
|
|
|
|
|
|
100 – |
|
|
|
|
|
|
|
|
|||
- |
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
||
0 |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Время, мин |
|
|
|
|
|
Время, мин |
|
||||||||||
|
|
|
|
в |
|
|
|
|
|
|
|
г |
|
|||||||
|
|
|
|
|
|
t,0C |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
- |
|
|
|
Se 100% |
|
|||||||||||||
|
|
400 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
300 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
200 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
-
100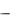
-

71
0
Время, мин
д
Рис. 8. Кривые охлаждения сплава Cd – Se
Вопросы для самоконтроля и повторения
1.Что такое металлы? Какими химическими свойствами они обладают?
2.Что такое сплавы? Назовите типы сплавов по основному компоненту.
3.Что такое кривая охлаждения?
4.Что представляет собой диаграмма состояния сплава? Какие типы диаграмм состояния Вы знаете?
5.Принцип построения диаграммы состояния по кривым охлаждения.
Лабораторная работа № 5
ХИМИЯ НЕМЕТАЛЛИЧЕСКИХ ЭЛЕМЕНТОВ
Цель работы: ознакомиться со способами получения и химическими свойствами соединений р-элементов III, IV и V групп периодической таблицы Д.И. Менделеева.
Теоретическая часть
Простые вещества относятся к металлам и неметаллам в зависимости от типа химической связи между атомами. Для металлов характерна металлическая связь, для неметаллов – ковалентная. Как нет резкого различия между металлической и ковалентной связью, так и не может быть резкого различия между металлическими и неметаллическими простыми веществами.
Инструментальные и абразивные материалы, используемые для механической обработки металлов, отличаются от конструкционных (металлических) материалов большей механической прочностью, твердостью, термической и химической стойкостью. Такие свойства имеют вещества, кристаллические решетки которых относятся к атомному типу. Атомный тип кристаллических решеток встречается у элементарных веществ и простых соединений, образованных химическими элементами промежуточного характера, к которым относятся бор, углерод, кремний, германий, сурьма. Электрические свойства веществ, образованных последними тремя элементами, дали возможность использовать их также и в качестве полупроводниковых материалов.
72
Свойства конструкционных и инструментальных материалов очень сильно зависят от температуры и других условий. Эти зависимости инженеру необходимо хорошо знать, поскольку разнообразные машины, приборы, аппараты и сооружения эксплуатируются в условиях широкого диапазона температур, а иногда и в сильно агрессивных средах.
Бор
Бор в свободном состоянии встречается в виде двух видоизменений - кристаллического и аморфного. По твердости среди элементарных веществ кристаллический бор занимает второе место после алмаза. Аморфный бор представляет собой порошок коричневого цвета.
При высоких температурах бор взаимодействует с кислородом, образуя оксид бора B2O3. При взаимодействии оксида бора с водой образуется слабая борная ортокислота В2О3 +3Н2О=2Н3ВО3.
Соли борной кислоты называются боратами. Тетрабораты, соли тетраборной кислоты Na2B4O7, образуются при нейтрализации борной ортокислоты растворами щелочей
4H3BO3 + 2NaOH = Na2B4O7+7Н2О.
Тетраборат натрия образует с 10 молекулами воды кристаллогидрат
.Na2B4O7 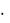 10 H2O, называемый обычно бура.
10 H2O, называемый обычно бура.
Нитрид бора BN существует в гексагональной и кубической сингонии. Кубический нитрид бора (боразон) благодаря своей исключительной твердости имеет перспективное значение как инструментальный материал.
Углерод
Углерод встречается в виде трех модификаций – алмаз, графит и карбин. Каждая из них отвечает определенному типу гибридизации электронных орбиталей в атомах углерода. При sp3-гибридизации орбиталей образуется кристаллический полимер углерода с атомной координационной кубической решеткой – алмаз. Вследствие sp3-гибридизации электронных орбиталей каждый атом углерода в алмазе образует равноценные прочные -связи с четырьмя соседними атомами углерода (рис.1).
Такая структура полимера объясняет очень высокую твердость алмаза, отсутствие у него электронной проводимости и крайне низкую энтропию (Sалмаз =2,4 Дж /(моль-К)) по сравнению с другими модификациями углерода.
73
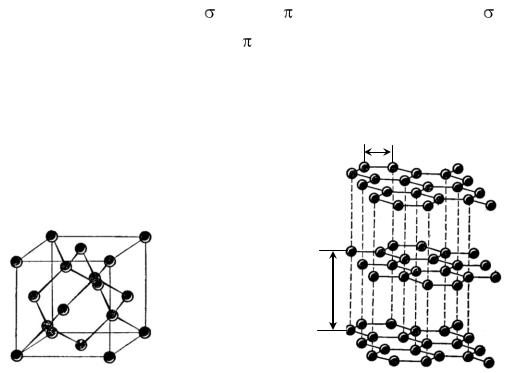
При sp2-гибридизации орбиталей образуется кристаллический полимер углерода с гексагональной сложной структурой – графит (рис.2).
sp-гибридизация электронных орбиталей в атоме углерода приводит к возникновению прямолинейных цепочек, в которых каждый атом углерода способен к образованию двух - и двух -связей. В образовании -связей участвуют гибридные sp-орбитали, а -связей - негибридизованные р-орбитали. Кристаллический полимер описанной структуры – карбин. Это черный порошок с плотностью меньшей, а энтропией большей, чем у графита и алмаза. Карбин – полупроводник.
0,35 нм
Рис.1. Кристаллическая решетка алмаза |
Рис. 2. Кристаллическая решетка графита |
Своеобразная структура кристаллов графита обуславливает его мягкость, на этом основано его применение в качестве смазочного материала. Между трущимися деталями машин графит измельчается в тончайшие чешуйки, устилающие неровности и облегчающие скольжение трущихся поверхностей.
От смазочных масел графит выгодно отличается относительной термической и химической стойкостью.
Из графита изготавливают различные детали машин, подшипники, поршневые кольца и др. Его применяют как материал для аппаратов химических и металлургических производств теплообменников, тиглей для тугоплавких сплавов и др.
Алмаз благодаря своей исключительной твердости приобрел важное значение как инструментальный материал. С помощью алмазных резцов и сверл обрабатывают различные твердые материалы, окончательно обрабаты-
74
вают поверхности наиболее ответственных деталей авиационных и автомобильных двигателей. Алмазным инструментом обрабатывают цветные металлы и особо твердые сплавы. Специально ограненные алмазы применяют в качестве деталей очень точных приборов. Алмазный порошок как абразивный материал используют для тонкой обработки различных твердых материалов. Для этого из стали (или меди) изготовляют алмазные круги, в поверхность которых втирается алмазный порошок на специальной цементирующей связке.
Из соединений углерода особое место занимают карбиды.
Карбиды – это соединения углерода с металлами, кремнием, бором. Карбиды щелочных, щелочноземельных элементов (ацетиленида) представляют собой солеподобные соединения с ионным типом связи между углеродом и элементом (кратность связи между атомами углерода равна трем). Поэтому при их взаимодействии с водой образуется ацетилен
СаС2+2Н2О = Са(ОН)2+ С2Н2.
Карбиды алюминия и некоторых других активных металлов также разлагаются водой с образованием углеводородов
Al4C3+ 12H2O = 4 Al(ОН)3+ ЗСН4.
Ацетилениды меди (Cu2С2), серебра (Ag2C2), золота (Au2C2), ртути (HgC) при ударе и нагревании разлагаются со взрывом. Карбиды d-элементов IV-VII групп и группы железа относятся к металлоподобным соединениям, у которых в узлах кристаллических решеток находятся ионы металла, а в пустотах решеток – атомы углерода. Эти соединения имеют интерметаллидный характер переменного состава и характеризуются электрической проводимостью, высокими твердостью и температурой плавления. Например tпл ТаС равна 3900 оС, а сплава (HfC – 20 % и ТаС-80 %) – 4400 °С. Карбиды обладают химической стойкостью. Так, карбиды тантала, ниобия и гафния не реагируют даже с царской водкой.
Карбиды кремния SiC, бора B4S представляют собой ковалентные соединения и обладают высокой твердостью, жаро- и химической стойкостью.
Карбиды используются в качестве абразивных материалов (B4S), огнеупоров (B4S, ТаС), полупроводниковых материалов (В4С), металлокерамических твердых сплавов (W2S, TiC, ТаС), как легирующие добавки при получении жаропрочной стали. Карбид кальция СаС2 применяется для получения ацетилена.
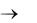
75
Кремний
Кремний в свободном состоянии встречается в кристаллическом и аморфном видоизменениях. Кристаллический кремний (кубическая решетка) имеет высокую твердость и напоминает по внешнему виду темно-серый металл. При комнатной температуре кремнии является полупроводником и используется в полупроводниковой технике.
Оксид кремния SiО2 имеет кислотный характер. Соответствующие ему кремниевые кислоты (мета- H2SiО3, орто- H4SiO4) являются очень слабыми. Оксид кремния совершенно нерастворим в воде, в различных кислотах и очень медленно растворяется в растворах щелочей. При сплавлении со щелочами получаются соли, называемые силикатами, например
t oC |
|
SiO2:+2NaOH –– |
Na2SiO3 + H2O. |
Большинство силикатов нерастворимо в воде, лишь силикаты щелочных металлов образуют с водой вязкие растворы, известные под названием жидкое (растворимое) стекло. При действии на эти растворы кислот из них выпадает в виде геля кремниевая кислота
SiO4-4 + 4H+ = H4SiO4
Гели кремниевой кислоты представляют собой белую пористую массусиликагель, обладающую очень большой адсорбционной способностью.
Большое значение имеют искусственно изготовляемые силикаты, среди них стекло. Обыкновенное оконное стекло представляет собой трисиликат натрия - кальция примерного состава Na2Ca(Si3O7)2. Его получают сплавлением песка SiO2 с карбонатами натрия (сода) и карбоната кальция (известняк) при температуре около 1400 °С.
При введении в стеклянную массу оксидов или карбонатов других металлов получают различные специальные сорта стекол. Стекло находится в аморфном состоянии. Однако при термической обработке стекло может приобрести кристаллическую структуру. Такие микрокристаллические материалы, называемые ситаллами, обладают большой прочностью и тугоплавкостью.
Посредством совмещения стекловолокна с различными синтетическими полимерами получают так называемые стеклопластики, отличающиеся легкостью и коррозионной стойкостью. Применяют их в качестве конструкционных материалов.
76
Важнейшим строительным материалом является силикатный цемент, который получают обжигом смеси известняка и глины. Смеси песка, гравия или щебня с цементом и водой образуют после отвердевания бетон.
Искусственные силикаты широко используются также в виде различного рода керамики. К керамическим изделиям относятся кирпич, гончарные трубы, огнеупорные материалы, а также фарфор и фаянс. Различные виды силикатной керамики используют в металлургическом машиностроении в качестве огнеупоров (динасовые, шамотные и другие изделия).
Силикатные эмали применяют для защиты металлических поверхностей oт действия высокой температуры.
При взаимодействии кремния с азотом при 1000 °С образуется нитрид кремния
3Si+2N2= Si3N4.
Нитрид кремния – тугоплавкое вещество (tпл = 1950 °C), обладающее полупроводниковыми свойствами, химически очень стойкое. При 2000 °С образуется карбид кремния
Si+C= SiC.
Карбид кремния, или так называемый карборунд SiC, имеет чрезвычайно большую твердость (в этом отношении он лишь немногим уступаем алмазу) и химически инертен.
При взаимодействии кремния с большинством металлов при высоких температурах образуются силиды (силициды). Силиды во многом аналогичны карбидам, однако в большей степени, чем последние, напоминают интерметаллические соединения. Эти соединения отличаются значительной твердостью, тугоплавкостью и химической инертностью. Силиды тяжелых металлов применяют для получения твердых жаро- и кислотостойких материалов.
Полупроводниковые материалы на основе кремния, германия, сурьмы и висмута
Элементарный кремний, как уже отмечалось, используется в полупроводниковой технике. Германий является важнейшим полупроводниковым материалом. Полупроводниковыми свойствами, помимо элементарных германия и кремния, отличаются также некоторые соединения, а именно: оксиды, сульфиды, селениды, фосфиды, аренды и т.п.
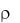
77
В свободном состоянии сурьма и висмут, хотя но внешнему виду и напоминают металлы, но типичные для металлов свойства выражены них очень слабо. Они хрупки и по электрической проводимости довольно сильно уступают настоящим металлам. Сурьма и висмут образуют сплавы с большинством металлов. В сплавах сурьмы с галлием, индием и таллием получаются стибиды с полупроводниковыми свойствами. Важное значение имеют подшипниковые и типографские сплавы сурьмы. Легкоплавкие подшипниковые сплавы, так называемые баббиты, широко применяются в современном машиностроении в качестве материала для изготовления вкладышей для подшипников.
Висмут используется в технике в основном как составная часть специальных легкоплавких сплавов.
В данной лабораторной работе изучаются химические свойства соединении бора, углерода, кремния, висмута.
Экспериментальная часть
Опыт 1. Получение ортоборной (борной) кислоты
Порядок проведения эксперимента. Из всех борных кислот устойчи-
вой в растворах является ортокислота H3BO3.
Поэтому при действии любой сильной кислоты на бораты образуется Н3BO3. Налить в пробирку 5 мл насыщенного раствора тетрабората натрия (бура) Na2B4O7 и добавить в неѐ 2 мл концентрированной НCl ( = 1,19). Что наблюдается?
Запишите данные опыта. Напишите уравнение реакции получения борной кислоты. Отметьте наблюдаемые явления. Солью какой кислоты является тетраборат натрия?
Опыт 2. Гидролиз тетрабората натрия
Порядок проведения эксперимента. В две пробирки налить по 2 мл дис-
тиллированной воды и прибавить в каждую по 4-5 капель розового раствора лакмуса. Растворить в одной из пробирок несколько кристаллов буры. Сравнить окраску в обеих пробирках.
Запишите данные опыта. Отметьте и объясните изменение окраски растворов. Напишите уравнения реакции ступенчатого гидролиза тетрабората натрия, учитывая, что в результате первой ступени гидролиза образуется орто-
78
борная кислота и метаборат натрия NaBO2 и по второй ступени – ортоборная кислота и едкий натр.
Опыт 3. Соли угольной кислоты (карбонаты) Порядок проведения эксперимента.
а) В четыре пробирки поместить: в первую MgCO3, во вторую – СаСО3,
втретью - NaHCO3, в четвертую - Na2CO3.
Вкаждую из пробирок прибавьте по 1 мл 1н раствора хлороводородной кислоты. Что наблюдается?
Запишите данные опыта. Составьте уравнения реакций.
Порядок проведения эксперимента.
б) В три пробирки налить по 1мл растворов солей: в первую СаCl2, во вторую ВаСl2, в третью Pb(NO3)2. В каждую добавить по 1мл раствора Na2CO3 Что наблюдается? Отметить цвет осадков.
Запишите данные опыта. Отметьте наблюдаемые явления. Составьте уравнения реакций.
Порядок проведения эксперимента.
в) В две пробирки налить по 2 мл дистиллированной воды и по 2-3 капли раствора фенолфталеина. Внести в первую пробирку несколько кристаллов карбоната натрия Na2CO3, а во вторую – гидрокарбоната натрия NaНСО3. Наблюдать появление окраски. Объяснить, почему окраска растворов различна?
Запишите данные опыта. Объясните наблюдаемые явления. Ответьте на поставленный вопрос. Составьте уравнения реакции гидролиза взятых солей.
Опыт 4. Свойства карбида кальция
Порядок проведения эксперимента. Опыт проводится под тягой. По-
местить в пробирку (немного!) карбида кальция СаС2 и добавить воды. Что наблюдается?
Запишите данные опыта. Отметьте наблюдаемые явления. Составьте уравнение реакции. Дайте характеристику различных известных вам карбидов.
Опыт 5. Получение геля и золя кремниевой кислоты
Порядок проведения эксперимента. В две пробирки внести по 1мл: в
одну – силиката натрия Na2SiO3, в другую – концентрированной хлороводородной кислоты (плотность 1,19 г/см3). Добавить в первую пробирку 1мл 2 н.

79
раствора хлороводородной кислоты, а во вторую – 1-2 капли насыщенного раствора силиката натрия. Закрыть пробирки пальцем и встряхнуть их. Наблюдать образование геля кремниевой кислоты в первой пробирке и золя – во второй Полученный золь кремниевой кислоты нагреть до перехода в гель. Как называется процесс перехода золя в гель? Какое значение имеет нагревание?
Запишите данные опыта. Отметьте наблюдаемые явления. Ответьте на вопросы. Напишите уравнения реакции получения кремниевой кислоты Н2SiO3 (данная формула является условной, действительный состав кремниевых кислот более сложный и может быть выражен общей формулой SiO2 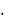 хH2O).
хH2O).
Опыт 6. Гидролиз солей кремниевой кислоты (силикатов)
Порядок проведения эксперимента. В две пробирки внести по 1 мл раствора силиката натрия, в одну из них добавить 1-2 капли фенолфталеина. Отметить появление красной окраски. На избыток какого иона это указывает? Во вторую пробирку добавить 1мл раствора хлорида аммония. Что наблюдается?
Запишите данные опыта. Отметьте наблюдаемые явления и объясните различие в степени гидролиза силиката натрия в чистой воде и в присутствии хлорида аммония. Напишите молекулярные и ионные уравнения обоих случаев гидролиза. Присутствие какого иона увеличило степень гидролиза во втором случае? Как уменьшить гидролиз силиката натрия?
Опыт 7. Восстановление Bi+3 до элементарного висмута
Порядок проведения эксперимента. Внести в пробирку две капли рас-
твора хлорида олова (II) SnCl2 и прибавить по каплям раствор NaOH до тех пор, пока выпавший осадок Sn(OH)2 не растворится. Составить уравнения реакций, зная, что образуется комплексный ион [Sn(OH)4]2-.
Прибавить к полученному раствору каплю раствора соли висмута Bi+3(NO3)3 и отметить появление черного осадка элементарного висмута.
Уравнения реакций в ионном виде: |
|
Bi+3 + 3OH– |
Bi(OH)3; |
2Bi(OH)3+3[Sn(OH4)]2- |
2Bi0 + 3[Sn(OH)6]2-. |
Запишите данные опыта. Опишите наблюдаемые явления. Составьте уравнения реакций в молекулярном виде. Примите к сведению, что не склонный к
