
химия лабораторный практикум
.pdf
20
Ход определения
В две конические колбы с помощью мерной посуды отмеряют по 100 мл водопроводной воды. Добавляют в эти же колбы по 5 мл буферной смеси и на кончике шпателя – индикатор хромоген черный до получения винно-красной окраски. Одна из колб служит контрольной. Далее титруют пробу из бюретки раствором трилона Б до тех пор, пока от одной капли трилона Б окраска перейдет из винно-красной в синюю. Титрование повторяют с новой порцией воды и при сходных результатах между двумя значениями объема трилона Б, пошедшего на титрование (разница не более 0,2 мл), находят среднее арифметическое значение.
Расчет общей жесткости воды производят по формуле
Жобщ |
Сн(тр) |
V(тр) |
1000 |
, |
|
|
VH |
O |
|
||
|
|
2 |
|
|
|
где Жобщ.– общая жесткость воды, ммоль/л; С н(тр) – нормальная концентрация трилона Б, моль/л; V(тр) – объем трилона Б, израсходованный на титрование, мл; VH2O – объем исследуемой пробы воды, мл.
Постоянную (некарбонатную) жесткость воды находят по разности общей и временной (карбонатной) жесткости
Жпост.= Жобщ.– Жвр.
По полученным данным характеризуют жесткость исследуемой воды.
Вопросы для самоконтроля и повторения:
1.Какой количественный метод химического анализа используют для определения временной жесткости воды?
2.Каким методом определяют общую жесткость воды?
3.В чем суть титриметрического метода анализа?

21
Учебно-исследовательская работа
Определение концентрации раствора формальдегида методом потенциометрического титрования
Цель работы: научиться определять концентрацию раствора формальдегида методом потенциометрического титрования
В нейтральной среде между формальдегидом и сульфитом натрия протекает реакция:
Н |
Н |
|
H C = O + Na2SO3 + H2O |
H C |
OH + NaOH. |
SO3Na
Количество выделившегося NaOH эквивалентно количеству прореагировавшего формальдегида. Поэтому, определив концентрацию NaOH, можно рассчитать концентрацию раствора формальдегида. Для этого образовавшийся в результате реакции NaOH оттитровывают раствором соляной кислоты. За точку эквивалентности принимают рН=10,4.
Ход определения
Для проведения титрования заполняют бюретку раствором соляной кислоты известной концентрации (0,1М). В коническую колбу отмеряют 10 мл раствора формальдегида и добавляют 10 мл Na2SO3. Проводят титрование раствором HCl до рН=10,4, что контролируют с помощью рН-метра. Записывают объем соляной кислоты, израсходованной на титрование. Титрование повторяют до результатов, разница между которыми не превышает 0,2 мл, и определяют среднее арифметическое значение.
Концентрацию раствора формальдегида (в %) рассчитывают по формуле
Сн( HCl ) V( HCl ) 3 ,
V
где Cн(HCl) – нормальная концентрация соляной кислоты; V(HCl) – объем раствора соляной кислоты, израсходованный на титрование, мл; моль/л; V –
объем раствора формальдегида, мл.
Вопросы для самоконтроля и повторения:
1.Какой количественный метод химического анализа используют для определения концентрации раствора формальдегида?
2.Какая химическая реакция лежит в основе определения формальдегида?
3.Как фиксируется точка эквивалентности в используемом методе анализа?
22
Лабораторная работа № 2
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ, АДСОРБЦИОННОЕ РАВНОВЕСИЕ.
Цель работы: определение адсорбционных характеристик различных сорбентов.
Теоретическая часть
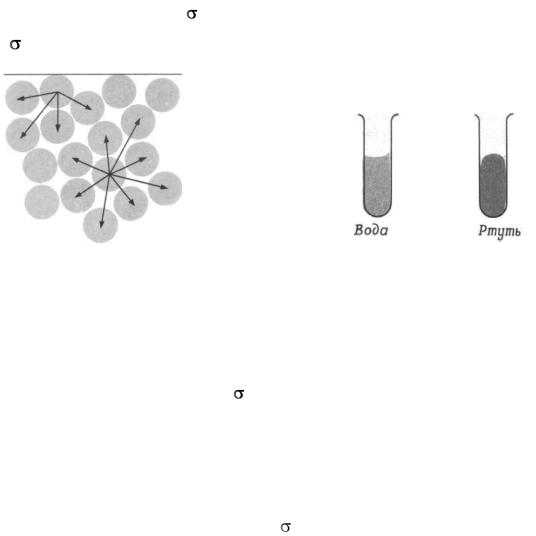
Межфазные, или поверхностные, явления – это явления, которые воз-
никают и протекают на границе раздела фаз, в межфазном поверхностном слое (рис. 1,2). Межфазные явления обусловлены тем, что молекулы, атомы или ионы, находящиеся на поверхности раздела фаз, неравноценны молекулам, атомам или ионам, находящимся внутри фазы, так как они обладают из-
быточной энергией, называемой свободной поверхностной энергией или по-
верхностным натяжением ( ), если эта энергия относится к единице поверхности ( измеряется в СИ Дж/м2 или Н/м).
Рис. 1. Объяснение на молекулярном уровне |
Рис. 2. Формы менисков воды и ртути |
причин возникновения поверхностного натя- |
в стеклянных трубках |
жения: межмолекулярные силы, действующие |
|
на молекулу, находящуюся вблизи поверхности |
|
жидкости, не уравновешивают друг друга |
|
Поверхностное натяжение является важной физико-химической характеристикой твердых и жидких тел. При постоянной температуре эта величина характеризует полярность жидкости. При рассмотрении поверхностных явлений полярность означает интенсивность поля молекулярных сил и связана с такими параметрами жидкости, как дипольный момент, поляризуемость, диэлектрическая проницаемость. Значение для границы жидкости с воздухом и

23
с собственным паром практически совпадает при Т << Ткр. Для границы двух несмешивающихся жидкостей является величиной суммарной и определяется по правилу Антонова:
ж ж = |
ж г – |
ж г , |
(1) |
|
1 |
2 |
1 |
2 |
|
где ж1 и ж2 – 1-я и 2-я жидкости, г – газ.
С уменьшением разности полярности взаимная растворимость жидкостей увеличивается.
Представление о поверхностном натяжении на границе твердого тела с жидкостью или газом несколько условно вследствие необратимости процессов образования новой поверхности. Значение гт и жт для большинства твердых тел больше жг и жж, поскольку интенсивность силового поля в твердых телах больше, чем в жидкостях (ж – жидкая фаза, г – газовая фаза, т – твердая фаза).
Известно, что все самопроизвольные процессы происходят в направлении уменьшения энергии Гиббса. Аналогично на границе раздела фаз самопроизвольно происходят процессы в направлении уменьшения свободной энергии, равной произведению ее удельного значения ( ) на площадь поверхности (S). Во всех системах произведение  S стремится к минимальному значению, возможному для данной системы при сохранении постоянства ее объема. Вследствие этого дисперсные системы принципиально термодинамически неустойчивы.
S стремится к минимальному значению, возможному для данной системы при сохранении постоянства ее объема. Вследствие этого дисперсные системы принципиально термодинамически неустойчивы.
Поверхностная энергия, зависящая от состава жидкой фазы и от температуры, представлена термодинамической функцией – свободная энергия
Гиббса для поверхности:
Gпов = Hпов – T Sпов = 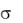 S, (2)
S, (2)
где Gпов – энергия Гиббса; Sпов – энтропия поверхности;
Hпов – энтальпия поверхности; – поверхностное натяжение; S – площадь поверхности.
При достижении равновесия Gпов стремится к минимальному значению. Уменьшение энергии Гиббса для поверхности в изотермических условиях может быть получено за счет уменьшения поверхности (например, стягивания капли) или за счет снижения поверхностного натяжения (адсорбция, изменение состава жидкости). Оба фактора могут действовать одновременно.

24
Наличие свободной поверхностной энергии проявляется во множестве явлений. Например, в самопроизвольном стремлении капли жидкости, взвешанной в другой несмешивающейся в ней жидкости, принять форму шара, т.е. форму тела с наименьшей поверхностной энергией (например, в системе мас-
ло - вода). Это отвечает принципу Гиббса-Кюри: термодинамически устой-
чива такая внешняя форма твердого или жидкого тела, при которой его суммарная поверхностная энергия будет наименьшей.
Следовательно, поверхностное натяжение характеризуют силы межмолекулярного взаимодействия, количественно выраженные работой по переводу соответствующего числа молекул из объема в поверхностный слой раздела фаз.
Поверхностное натяжение зависит от следующих факторов:
-химической природы вещества (табл.1);
-температуры.
Таблица 1
Поверхностное натяжение некоторых жидкостей
Название |
Формула |
Т, К |
, Дж/м2 |
|
|
|
|
Водород |
Н2 |
14,9 |
0,00283 |
Аргон |
Ar |
84,9 |
0,0132 |
|
|
|
|
Кислород |
О2 |
90,0 |
0,0183 |
Метан |
СН4 |
93,0 |
0,0180 |
Бензол |
С6Н6 |
293,0 |
0,02887 |
Вода |
Н2О |
293,0 |
0,07275 |
Этанол |
С2Н5ОН |
293,0 |
0,02203 |
Глицерин |
С3Н8О3 |
291,0 |
0,06247 |
Анилин |
С6Н5NH2 |
293,0 |
0,04366 |
Хлорид серебра |
AgCl |
723,0 |
0,125 |
|
|
|
|
Карбонат натрия |
Na2CO3 |
1124,0 |
0,914 |
Алюминий |
Al |
933,0 |
0,914 |
|
|
|
|
Железо |
Fe |
1812,0 |
1,84 |
|
|
|
|
Медь |
Cu |
1356,0 |
1,351 |
|
|
|
|
С повышением температуры (Т)  уменьшается за счет ослабления межмолекулярного взаимодействия. При критической температуре (Ткрит.) граница между жидкостями исчезает и = 0.
уменьшается за счет ослабления межмолекулярного взаимодействия. При критической температуре (Ткрит.) граница между жидкостями исчезает и = 0.
25
Изучением влияния температуры на поверхностное натяжение занимался Этвеши, который показал, что поверхностное натяжение жидкости, измеренное на границе с насыщенным паром, убывает в зависимости от температуры соответственно следующему выражению:
= 0(Ткрит – Т) . |
(3) |
Уравнение Этвеши применимо к границе раздела между жидкостью и паром, но для межфазных границ раздела оно получает другой смысл.
Межфазное поверхностное натяжение вообще меньше, чем для свободных фаз. В табл. 2 представлены некоторые данные по межфазным поверхностным натяжениям.
Таблица 2
Межфазное поверхностное натяжение в различных системах
|
Ф а з ы |
Т, К |
, Дж/м2 |
первая |
вторая |
|
|
вода |
насыщенный пар |
293 |
0,07275 |
вода |
анилин |
299 |
0,0048 |
вода |
бензол |
298 |
0,0341 |
Для системы вода-анилин при критической температуре 440 К происходит исчезновение границы раздела между двумя жидкостями.
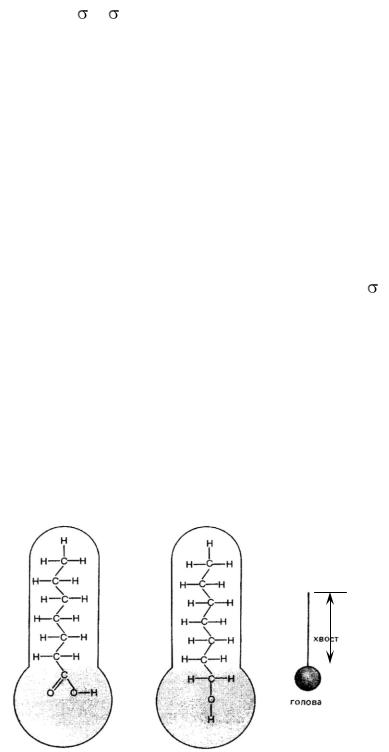
Концентрация также влияет на поверхностное натяжение. Влияние концентрации вещества определяется природой этого вещества (рис. 3).
|
хвост |
|
неполярная часть |
||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
полярная часть |
||
|
|
|
|
|
|
|
|
|
|
|
голова |
|
|
|
|
|
|
|
|
|
|
|
|
а) |
б) |
в) |
|
|
|
||
Рис. 3. Модель молекулы поверхностно-активного вещества: а – строение гепта-
новой кислоты, б – строение гептанового спирта, в – общая модель молекул ПАВ

26
Все вещества делятся на инактивные (кислоты, соли, щелочи) и поверх- ностно-активные вещества (ПАВ), к которым относятся спирты, органические кислоты, амины, фенолы, белки и т.д. При увеличении концентрации инактивного вещества поверхностное натяжение увеличивается. Если увеличивается концентрация поверхностно активного вещества, поверхностное натяжение уменьшается (рис.4).
3
2
1
С
Рис.4. Влияние концентрации вещества (С) на поверхностное натяжение ( ): 1,2 – система бензол-вода; 3 – система соль-вода
Концентрация бензола в системе 2 выше, чем в системе 1.
Ценные практические свойства ПАВ обусловили интенсивное развитие их производства и все более широкое внедрение в разнообразные отрасли народного хозяйства. ПАВ – это моющие средства, эмульгаторы в процессах эмульсионной полимеризации, текстильно-вспомогательные средства в процессах отделки тканей, флотореагенты при обогащении руд и углей, деэмульгаторы при обезвоживании и обессоливании нефтей, необходимые компоненты смазочно-охлаждающих жидкостей, пластических смазок, стабилизаторы различных дисперсных систем.
Существование избыточной энергии на границе раздела фаз может быть объяснено следующим образом. Каждая молекула внутри фазы испытывает приблизительно одинаковое притяжение окружающих ее молекул, и силовое поле такой молекулы симметрично насыщено. Молекула, находящаяся в поверхностном слое, окружена многими молекулами асимметрично, и часть ее силового поля находится вне фазы, т.е. силовое поле такой молекулы ненасыщено. Эта ненасыщенность силового поля поверхностных молекул и является источником избыточной поверхностной энергии.
27
Как было показано выше, поверхностная энергия стремится самопроизвольно уменьшиться. Это выражается в уменьшении межфазной поверхности, или поверхностного натяжения. К явлениям, происходящим вследствие стремления к самопроизвольному снижению поверхностного натяжения, относится
адсорбция.
Сорбция – процесс поглощения одного вещества (сорбата) другим (сорбентом). Если вещество поглощается всем объемом другого вещества, то происходит абсорбция, если только поверхностью – адсорбция.
Таким образом, адсорбцией называется изменение концентрации адсорбата в поверхностном слое по сравнению с объемной фазой, отнесенное к единице поверхности адсорбента (г/м2, моль/м2). Часто из-за сложности определения величины поверхности адсорбентов количество адсорбированного вещества относят к единице массы (г/г, моль/г).
Адсорбция – самопроизвольный процесс, сопровождающийся убылью свободной энергии Гиббса G 0. Энтальпия адсорбции также имеет отрицательное значение ( Н 0), так как адсорбция – это экзотермический процесс.
Чем больше энергия взаимодействия адсорбата с поверхностью адсорбента, тем больше времени молекулы адсорбируемого вещества удерживаются на поверхности раздела фаз, то есть находятся в адсорбированном состоянии. Время адсорбции ( ) молекул на поверхности адсорбента определяется уравнением
0 e H / R T , |
(4) |
где 0 – постоянная, зависящая от природы адсорбента и адсорбата; Н – энтальпия (тепловой эффект адсорбции);
R – универсальная газовая постоянная; Т – температура (шкала Кельвина).
При адсорбции смеси веществ у границы раздела фаз будет накапливаться тот компонент, время адсорбции которого больше.
Адсорбция представляет собой процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. При адсорбции в многокомпонентных системах в поверхностный слой предпочтительнее переходит тот компонент, который сильнее уменьшает межфазное (поверхностное) натяжение.
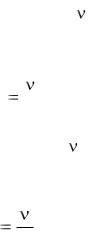
28
Вещество, которое поглощается или концентрируется на поверхности раздела фаз, называется адсорбтивом (для жидкостей) или адсорбатом (для газов). Вещество, на поверхности которого происходит концентрация адсорбтива (адсорбата), называется адсорбентом. Величина адсорбции а определяется количеством адсорбтива (адсорбата) к единице площади поверхности S адсорбента и выражается в киломолях на квадратный метр (кмоль/м2)
a |
|
|
(5) |
|
S |
||||
|
|
|||
или количеством адсорбтива (адсорбата) |
к единице его массы m и выражает- |
|||
ся в киломолях на килограмм (удельная адсорбция) |
||||
a |
|
m . |
(6) |
При установлении равновесия в системе количество адсорбированного вещества в поверхностном слое находится в определенной зависимости от концентрации (или парциального давления) этого компонента в объеме и от температуры. Число параметров, определяющих состояние системы, легко получить, применив правило фаз Гиббса:
С = К – Ф + 2, |
(7) |
где С – число степеней свободы; К – число компонентов в системе; Ф – число фаз;
2 – число параметров (давление или концентрация и температура).
В простейшем случае, при адсорбции из газовой фазы, система состоит из адсорбента и газа-адсорбата. Для этой системы число компонентов равно 2, число фаз составляет 2 и в соответствии с правилом фаз Гиббса число степеней свободы также равно 2. Это значит, что можно произвольно изменять два параметра (давление и температуру), при определенных значениях которых фиксируется равновесное состояние системы. Если система состоит из конденсированных фаз (твердой и жидкой), то адсорбируется растворенное вещество и число компонентов в ней будет равно 3. Обычно для конденсированной системы пренебрегают влиянием давлениям, и тогда в ней число степеней свободы также оказывается равным 2. Это означает, что можно произвольно изме-
29
нять два параметра: концентрацию и температуру. Таким образом, любой из параметров системы однозначно может быть определен как минимум через два других параметра. Как следует из примеров, этими параметрами могут быть концентрация (давление) адсорбтива (адсорбата) и температура.
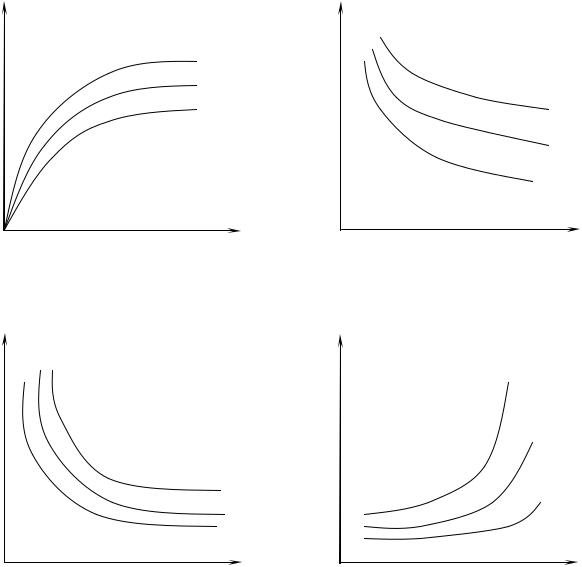
Зависимости адсорбции от |
данных параметров при T = const, a = f(C), |
a = f(p) графически выражаются |
кривыми, называемыми изотермами ад- |
сорбции (рис. 5). Зависимость a = f(T) при p = const или C = const графически выражается кривыми, называемыми изобарами или изопиками адсорб-
ции (рис. 6,7).
Зависимость вида С = f(T) при а = сonst называется изостерой адсорбции |
||
(рис. 8). |
|
|
а |
а |
|
Т1 |
|
|
Т2 |
Р1 |
|
Т3 |
||
|
||
|
Р2 |
|
|
Р3 |
|
С(р) |
Т |
|
Рис. 5. Изотермы адсорбции: Т1 < Т2 < Т3 |
Рис. 6. Изобары адсорбции: Р1 > Р2 > |
|
Р3 |
|
|
а |
С |
|
|
а1 |
|
|
а2 |
|
С1 |
а3 |
|
С2 |
||
|
||
С3 |
|
|
Т |
Т |
|
Рис.7. Изопики адсорбции: С1 > C2 > С3 |
Рис. 8. Изостеры адсорбции а1 > а2 > а3 |
