
химия лабораторный практикум
.pdf60
Всовременной промышленности используются чистые и особо чистые металлы (электротехническая, микроэлектронная промышленность и др.), и в большом количестве металлические сплавы. Самым распространенным из них является сталь. В природе существует лишь около 80 металлов, но из них могут быть созданы миллионы сплавов.
Вжидком состоянии большинство металлов растворяются друг в друге образуя однородный жидкий сплав. При кристаллизации металлы ведут себя по-разному, основными случаями являются при этом следующие три.
1.В твердом состоянии сплавляемые металлы не растворяются и химически не взаимодействуют друг с другом. При этом образуется механическая смесь, состоящая из кристаллитов разных металлов.
2.Сплавляемые металлы взаимодействуют друг с другом, образуя химические соединения.
3.При кристаллизации растворимость металлов друг в друге сохраняется, и образуются однородные кристаллы. В этом случае твердая фаза носит название твердого раствора. У одних металлов взаимная растворимость неограниченна, другие растворяются лишь до определенной концентрации.
Следовательно, сплавы образуются при смешивании двух или более
расплавленных металлов, а также металлов с некоторыми неметаллами с последующим их затвердением.
Кристаллическая структура сплавов аналогична чистым металлам и специфические свойства присущи сплавам в кристаллическом состоянии. Свойства сплавов определяются составом, температурой и природой химического взаимодействия. Температура плавления сплавов обычно ниже, а прочность и твердость выше, чем у исходных металлов.
Чистые металлы не всегда удовлетворяют всем требованиям, предъявляемым к современным материалам. Такие свойства, как жаропрочность, коррозионная стойкость, повышенная механическая прочность и др., характерны для большинства сплавов. В настоящее время в технике применяются более пяти тысяч сплавов, наиболее распространенные из них приведены ниже.
Сталь - сплав железа с небольшим количеством углерода (до 1,7 %) и легирующими добавками Mn, Si, S, P, Cr, Ni и др. По сравнению с чистым железом стали обладают большей коррозионной стойкостью и прочностью.
Чугун – сплав железа с углеродом (более 1,7% до 4%), содержащий легирующие добавки. Этот сплав очень тверд и хрупок.

61
Сталь, чугун, железо называют черными металлами, остальные металлы и сплавы – цветными.
Инвар  слав железа с никелем (36%), марганцем (0,5%) и углерода (0,5%), практически не расширяется при нагревании.
слав железа с никелем (36%), марганцем (0,5%) и углерода (0,5%), практически не расширяется при нагревании.
Нержавеющая сталь например, сплав железа с хромом (18%) и нике-
лем (9%).
Бронза – сплав меди с другими металлами. Оловянная бронза содержит 70-96 % меди и 30-4% олова. Алюминиевая бронза содержит 5-10 % Al и до-
бавки Fe, Mn, Ni.
Латунь – сплав меди (54 - 90%) с цинком (46 – 10%). Мельхиор – сплав меди (60% ), никеля (22%) и цинка (18%). Томпак – сплав меди (86%), олова (10%) и цинка (45%).
Константан – сплав меди (58,5 %), никеля (40%) и марганца (1,5%). Копель – сплав меди (56,5%), никеля (43% ) и марганца (0,5%).
Все медные сплавы обладают высокой стойкостью против атмосферной коррозии.
Дюралюминий – сплав алюминия (94%), меди (4%) и по 0,5% магния, марганца, железа и кремния.
Силумин – сплав алюминия (85–90%), кремния (10–14%) и натрия 0,1%. Сплавы алюминия очень прочные (равны прочности стали), но в три раза легче и используются в автомобилестроении, судостроении, авиационной
технике и пр.
Бабиты – сплавы переменного состава, содержащие олово или свинец с добавками сурьмы, меди и др. Они уменьшают коэффициент трения и применяются в машиностроении.
Нихром – сплав никеля (67,5%), хрома (15%), железа (16%) и марганца
(1,5%).
Изучение природы сплавов, их особенностей и свойств, а также свойств чистых металлов – область науки, называемой металловедением.
Фазовые превращения. Правило фаз
Гетерогенные превращения, связанные с переходом вещества из одной фазы в другую без изменения химического состава, называются фазовыми. К ним относятся процессы плавления, испарения, конденсации и др. Фазовые равновесия являются динамическими и как химические равновесия должны

62
удовлетворять следующим условиям: энергия Гиббса процесса равна нулю ( G = 0), соблюдается принцип Ле Шателье.
Общим законом гетерогенных равновесий является правило фаз. Правило фаз было установлено в 1876 г. американским ученым Дж. Гиббсом. В законе используются такие понятия как фаза (Ф), компонент (К) и степень свободы (С).
Фазой называется однородная часть системы, имеющая одинаковые химический состав и свойства, отделенная от других частей системы поверхностью раздела.
Компонентом называется такая составная часть системы, которая является химически однородным веществом, может быть выделена из системы и существовать в изолированном виде в течении длительного времени.
Степень свободы – это число параметров (температура, давление, концентрация), которые можно произвольно изменять в определенных пределах без изменения числа и вида фаз.
Правило фаз устанавливает соотношение в равновесной гетерогенной системе между числом фаз, числом компонентов и степенями свободы.
Ф + С = К + n ,
где n – число внешних факторов, влияющих на равновесие системы, чаще всего это температура и давление. При этом n = 2 и уравнение принимает вид
С + Ф = К + 2 или С = К – Ф + 2.
Отсюда правило фаз формулируется следующим образом:
число степеней свободы системы равно числу независимых компонентов минус количество фаз плюс два.
Системы, для которых нет ни одной степени свободы, называются инвариантными или безвариантными. Такие системы могут существовать только при строго определенных значениях температуры, давления, концентрации. Изменение хотя бы одного из условий приводит к смещению равновесия и исчезновению, по меньшей мере, одной из фаз. Вода при температуре 273,16К (0,010 оС) и давлении 610 Па (4,58 мм.рт.ст.) находится в так называемой тройной точке (рис.2, точка О), когда в равновесии находятся три фазы, твердая (лед), жидкая и парообразная. Для данной системы число фаз равно трем,

63
количество компонентов одному, тогда |
С = 1 – 3 + 2 = 0, система инвариант- |
на. |
|
|
Системы с одной степенью свобо- |
|
ды называются моновариантными или |
|
одновариантными. В таких системах |
|
можно изменять в определенных пре- |
|
делах один из внешних факторов, не |
|
изменяя числа фаз системы. Например |
|
к таким системам относятся системы |
|
лед – вода, вода – пар, лед – пар (рис. 2, |
|
кривые ОА, ОВ, ОС). В этом случае |
|
число фаз равно двум, а число компо- |
|
нентов одному тогда С = 1 – 2 + 2 = 1, |
Рис. 2. Диаграмма состояния воды |
система моновариантна. |
Системы с двумя степенями свободы называются бивариантными. Вода в твердом, жидком и парообразном состоянии (площадь между кривыми рис. 2) имеет одну фазу и один компонент, тогда С = 1 – 1 + 2 = 2, система бивариантна. В этом случае, можно в достаточно широких пределах изменять температуру и давление, не изменяя количество фаз.
Могут существовать системы с большим числом компонентов и степеней свободы.
Основы физико-химического анализа
Создателем физико-химического анализа является крупнейший русский химик неорганик Н.С. Курнаков (1860 – 1941). По его инициативе в 1918 г. создан Институт физико-химического анализа при Академии наук России.
В основе физико-химического анализа лежит исследование зависимости физических свойств системы от ее состава или внешних условий. Это позволяет обнаружить и изучить происходящие в системе химические изменения. О химических изменениях в системе можно судить по характеру изменения температур плавления, кристаллизации, давления пара, вязкости, плотности, твердости, электропроводности системы в зависимости от ее состава. Результаты исследования представляют в виде диаграммы состав – свойство.
64
Из различных видов физико-химического анализа наиболее часто применяют термический анализ. При этом изучают и строят диаграмму плавкости, которая выражает зависимость температуры плавления системы от состава. Для получения диаграммы плавкости берут два чистых вещества и готовят из них смеси различного состава, которые расплавляют и затем медленно охлаждают, измеряя температуру затвердевания сплава, строя при этом кривые охлаждения.
Кривые охлаждения чистого вещества отличаются от кривых охлаждения сплавов. На рис. 3,а изображена кривая охлаждения чистого металла, точка ―а‖ соответствует началу охлаждения расплава. В точке ―в‖ начинается кристаллизация металла с выделением тепла и общая температура системы не изменяется. В точке ―с‖ металл закристаллизовался и температура уменьшается. Кривая охлаждения сплава имеет точку перегиба ―в‖ (рис.3,б), в этой точке начинается кристаллизация одного из компонентов сплава, затем (точка ―с‖) начинает кристаллизоваться весь сплав. При построении диаграммы состояния сплава используют температуру в точке перегиба.
t,oC |
а |
t,оC |
а |
в -
в |
|
с |
|
с |
|
d |
|
|
|
||||
|
|
d |
|
|
|
f |
|
|
|
|
|
|
|
|
Время, мин |
|
|
Время, мин |
||
|
а |
|
|
б |
||
Рис. 3. Кривые охлаждения: а – чистого металла, б – сплава
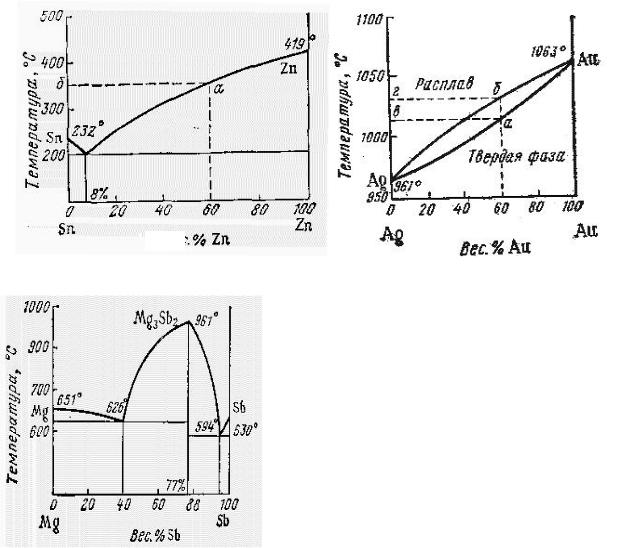
Диаграммы плавкости веществ, образующих эвтектическую смесь
При кристаллизации плохо растворимых друг в друге веществ образуется смесь мелкозернистых кристаллов, называемых звтектической смесью или просто звтектикой и на диаграмме плавкости есть минимум (рис. 4,а). Так, жидкое олово и свинец неограниченно растворимы друг в друге, но нерастворимы в твердом состоянии. Поэтому при медленном охлаждении расплава вначале кристаллизуется либо цинк, либо олово. Например, при охлаждении
65
расплава состава 60% Zn и 40% Sn в твердую фазу выделяется цинк, а олово остается в жидком виде. Температура кристаллизации сплава меньше температуры кристаллизации чистых веществ. По мере выделения цинка и обогащения системы оловом температура кристаллизации раствора все более понижается и при эвтектическом составе минимальна. К таким системам, кроме металлов, относятся, расплавы солевых систем (LiCl – KCl), простых веществ и соединений (Cu – CuO), растворы некоторых солей ( H2O – NaCl) и др.
Диаграмма плавкости веществ, образующих твердые растворы
Если вещества образуют жидкие и твердые растворы, то температура плавления не совпадает с температурой затвердевания расплава того же состава. То есть при одной и той же температуре состав жидкой и твердой фазы различен и на диаграмме плавкости имеются две кривые (рис. 4,б). Верхняя кривая отражает температуры затвердевания расплава, нижняя температуры плавления твердого раствора. К таким системам, например, относятся растворы Cu – Ni, Ag – Au и другие.
|
Мас. |
|
|
|
|
|
|
|
Мас. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а |
|
|
|
б |
|
Рис. 4. Диаграммы состояния систем:
а – образующие эвтектическую смесь, б – образующие твердые растворы,
в – образующие химические соединения

66
Мас.
Диаграммав плавкости систем, образующих химические соединения
Максимум на диаграмме плавкости означает, что в системе образуется химическое соединение. Так в системе Mg – Sb (рис. 4,в) максимум отвечает температуре плавления образовавшегося соединения Mg2Sb2. Подобные диаграммы представляют собой как бы сочетания двух диаграмм типа рис. 4,а. Минимумы на кривой плавкости соответствуют эвтектикам, образованным в системах Mg – Mg2Sb2 и Mg2Sb2 – Sb. Если число максимумов на диаграмме плавкости больше одного, то это означает, что компоненты, образуют несколько соединений.
Приведенные выше три главные диаграммы состояния отвечают простейшим случаям. Встречаются диаграммы более сложной формы, сочетающие признаки, свойственные отдельным простейшим случаям.
Фазовые равновесия подчиняются законам термодинамики и правилу фаз и могут быть охарактеризованы диаграммами состояния и плавкости.
Экспериментальная часть
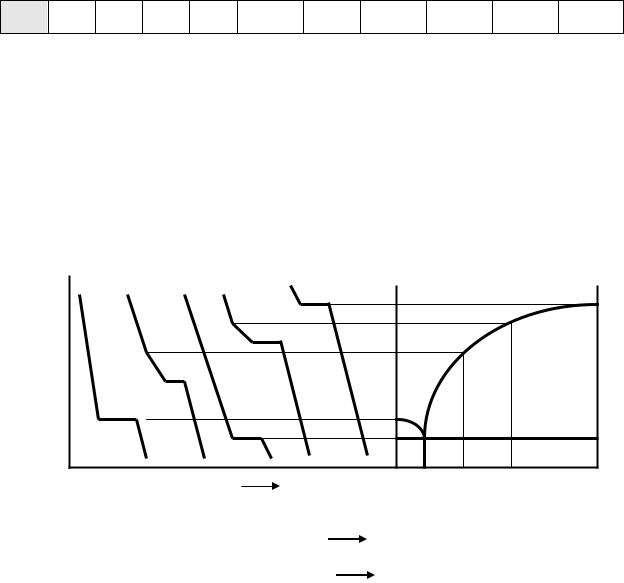
Порядок проведения эксперимента
Снятие кривых охлаждения
Снятие кривых охлаждения производится на установке, изображенной на
рис 5.
|
4 |
|
3 |
5 |
6 |
2 |
|
7 |
1 |
|
|
67
Рис. 5. Установка для снятия кривых охлаждения:
1 – легкоплавкий сплав, 2 – стакан с водой, 3 – горячий спай термопары, 4 – вольтметр, 5 – холодный спай термопары, 6 – сосуд со льдом
Включают вольтметр и водяную баню. После нагревания водяной бани до кипения и расплавления сплава нагрев выключают. По мере охлаждения проводят отсчет показаний вольтметра через каждые 30 секунд и заполняют табл. 1. Отсчет значений проводят до полного застывания сплава и в течение 5 минут после застывания. Пользуясь градуировочной таблицей 2, переводят значения термоэдс термопары в градусы Цельсия (t, оС). По данным табл. 1 строят кривую охлаждения в координатах время – t, оС.
Таблица 1
Время, мин
U, мВ
t, оС
Таблица 2
Градуировочная таблица для термопары хромель-алюмель Е, мВ
t, оС |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
|
|
|
|
|
|
|
|
|
10 |
0,40 |
0,44 |
0,48 |
0,52 |
0,56 |
0,60 |
0,64 |
0,68 |
0,72 |
0,76 |
|
|
|
|
|
|
|
|
|
|
|
20 |
0,80 |
0,84 |
0,88 |
0,92 |
0,96 |
1,00 |
1,04 |
1,08 |
1,12 |
1,16 |
|
|
|
|
|
|
|
|
|
|
|
30 |
1,20 |
0,24 |
1,28 |
1,32 |
1,36 |
1,41 |
1,45 |
1,49 |
1,53 |
1,57 |
|
|
|
|
|
|
|
|
|
|
|
40 |
1,61 |
1,65 |
1,69 |
1,73 |
1,77 |
1,82 |
1,86 |
1,90 |
1,94 |
1,98 |
|
|
|
|
|
|
|
|
|
|
|
50 |
2,02 |
2,06 |
2,10 |
2,14 |
2,18 |
2,23 |
2,27 |
2,31 |
2,35 |
2,39 |
|
|
|
|
|
|
|
|
|
|
|
60 |
2,43 |
2,47 |
2,51 |
2,56 |
2,60 |
2,64 |
2,68 |
2,72 |
2,77 |
2,81 |
|
|
|
|
|
|
|
|
|
|
|
70 |
2,85 |
2,89 |
2,93 |
2,97 |
3,01 |
3,06 |
3,10 |
3,14 |
3,18 |
3,22 |
|
|
|
|
|
|
|
|
|
|
|
80 |
3,26 |
3,30 |
3,34 |
3,39 |
3,43 |
3,47 |
3,51 |
3,55 |
3,60 |
3,64 |
|
|
|
|
|
|
|
|
|
|
|
90 |
3,68 |
3,72 |
3,76 |
3,81 |
3,85 |
3,89 |
3,93 |
3,97 |
4,02 |
4,06 |
|
|
|
|
|
|
|
|
|
|
|
100 |
4,10 |
4,14 |
4,18 |
4,22 |
4,26 |
4,31 |
4,35 |
4,39 |
4,43 |
4,47 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
68 |
|
|
|
|
110 |
4,51 |
|
4,55 |
4,59 |
|
4,63 |
4,67 |
4,72 |
4,76 |
4,80 |
4,84 |
4,88 |
|
|
|
|
Построение диаграмм состояния |
|
|
||||||
|
В этой части работы Вам необходимо на основании кривых охлаждения |
|||||||||||
(рис. 7,8) построить диаграмму состояния. По указанию преподавателя в лабо- |
||||||||||||
раторную тетрадь переносятся кривые охлаждения, как изображено на рис. 6. |
||||||||||||
t,0C 700 - |
1 |
|
2 |
3 |
4 |
|
5 |
|
|
|
|
|
600 - |
|
|
|
|
|
|
|
|
|
|
|
|
400 - |
|
|
|
|
|
|
|
|
|
|
|
|
300 - |
|
|
|
|
|
|
|
|
|
|
|
|
200 - |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
Время, мин. |
|
|
А |
Состав |
В |
||||
|
|
|
|
|
|
|
|
А |
100% |
|
50% |
0% |
|
|
|
|
|
|
|
|
В |
0% |
|
50% |
100% |
|
|
|
Рис. 6. |
Построение диаграммы состояния сплава |
|
|||||||
Для построения диаграммы состояния на оси абсцисс откладываете состав сплава, а на оси ординат–температуру в соответствующих масштабах. По кривой охлаждения 1 (рис.6) определяете температуру плавления чистого вещества, в данном случае Pb, и отмечаете это значение на левой оси ординат. По кривой 2 (рис.6) определяете процентный состав сплава и температуру плавления его по точке перегиба. Соответствующие значения переносите на диаграмму состояния. То же самое определяете по кривой 4. По кривой 3 определяете состав и температуру плавления эвтектической смеси. По кривой 5 определяете температуру плавления чистого вещества, в данном случае Sb и отме-

69
чаете это значение на правой оси ординат. Затем плавной кривой последовательно соединяете эти точки и проводите линию эвтектики. Диаграмма состояния построена.
t,0C |
|
|
|
|
|
|
|
|
|
t,0C |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
- |
|
|
|
Bi 100 % |
- |
|
|
|
|
Bi 60% |
|||||||||
400 |
|
|
|
|
|
|
|
400 |
|
|
|
|
|
|
Sn 20% |
||||
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|||||
300 |
|
|
|
|
|
|
|
|
|
300 – |
|
|
|
|
|
|
|||
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
200 |
|
|
|
|
|
|
|
|
|
200 – |
|
|
|
|
|
|
|||
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
||||
100 |
|
|
|
|
|
|
|
|
|
100 – |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
||||
0 |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
||
|
|
|
Время, мин |
|
|
|
|
|
|
|
|
Время, мин |
|||||||
|
|
|
|
а |
|
|
|
|
|
|
|
|
|
|
б |
||||
t,0C |
|
|
|
|
|
|
|
|
|
t,0C |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
- |
|
|
|
Bi |
58% |
- |
|
|
|
|
Bi 30% |
||||||||
400 – |
|
|
|
Sn |
42% |
|
|
400 – |
|
|
|
Sn 70% |
|||||||
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
||||
300 – |
|
|
|
|
|
|
|
|
|
300 – |
|
|
|
|
|
|
|||
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
||||
200 |
|
|
|
|
|
|
|
|
|
200 – |
|
|
|
|
|
||||
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
||||
100 |
|
|
|
|
|
|
|
|
|
100 – |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
||
|
|
Время, мин |
|
|
|
|
|
Время, мин |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
в |
|
|
|
|
|
|
|
|
|
|
|
г |
|||
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
Sn 100% |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
400 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
300 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
200 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
