
химия лабораторный практикум
.pdf
30
При изучении адсорбции наиболее важное значение имеют изотермы (рис. 5). Так как изотерма адсорбции по своему виду напоминает параболу, то Г. Фрейндлих предложил эмпирическое уравнение следующего вида:
в случае адсорбции газа |
|
|
а = K |
pn ; |
(8) |
в случае адсорбции из раствора |
|
|
а = К |
Сп, |
(9) |
где С – равновесная концентрация; К, п – эмпирические константы, характерные для данной системы.
Константы К и п определяются опытным путем, они характеризуют пригодность адсорбента для данного случая адсорбции. Величина К колеблется в широких пределах, п – характеризует степень приближения изотермы к прямой и изменяется для газов от 0,2 до 1,0; для растворов – от 0,1 до 0,5.
Если принять п = 1, то а = К  С, т. е. величина адсорбции прямо пропорциональна концентрации (давлению), В этом случае уравнения (8), (9) выражают закон Генри. Если п = 0, то а = К, т. е. величина адсорбции постоянна. Уравнение Фрейндлиха справедливо только для растворов средних концентраций адсорбтива. По уравнению Фрейндлиха невозможно рассчитать предельную адсорбцию. Для средних концентраций константы К и п могут быть найдены графическим методом (рис. 9).
С, т. е. величина адсорбции прямо пропорциональна концентрации (давлению), В этом случае уравнения (8), (9) выражают закон Генри. Если п = 0, то а = К, т. е. величина адсорбции постоянна. Уравнение Фрейндлиха справедливо только для растворов средних концентраций адсорбтива. По уравнению Фрейндлиха невозможно рассчитать предельную адсорбцию. Для средних концентраций константы К и п могут быть найдены графическим методом (рис. 9).
|
|
|
lg a |
|
-2 |
-1 |
0 |
lg C |
|
|
|
|
|
|
-1
lg K
А-2
lg a |
-3 |
lg С
Рис. 9. Зависимость lg a = f(lgC)

31
Путем логарифмирования уравнения (9) получаем уравнение прямой
lga = lgK + n lgC. |
(10) |
На графике зависимости lga = f(lgC) отрезок ОА равен lgK, величина n соответствует tg (рис. 9).
Природа адсорбционных сил
Различают два вида адсорбции: физическую, осуществляемую за счет сил Ван-дер-Ваальса, и химическую, или хемосорбцию, осуществляемую за счет сил химической природы, действующих между компонентом и поверхностным слоем.
Согласно современным представлениям, физическая адсорбция осуществляется обычными межмолекулярными силами, действующими между молекулами (или атомами), находящимися в разных фазах. Общим выражением данного взаимодействия является уравнение Леннарда-Джонса
U = - с r-6 + B r-12, |
(11) |
где первый член правой части уравнения характеризует энергию притяжения, второй – энергию отталкивания, обусловленную взаимодействием электронных оболочек.
Наиболее простым случаем адсорбции является адсорбция неполярной молекулы неполярным адсорбентом. Тогда первый член уравнения (11) будет определяться только действием дисперсионных сил притяжения.
Если на неполярном адсорбенте адсорбируются полярные молекулы адсорбтива, то постоянные диполи молекул адсорбтива поляризуют атомы адсорбента, вызывая образование в них индуцированных диполей и дипольдипольное взаимодействие. Аналогичные явления имеют место и при адсорбции неполярного адсорбтива на поверхности адсорбента, образованной ионами.
Индукционное электростатическое взаимодействие обычно невелико и может достигать не более нескольких килокалорий на моль.
Если полярные молекулы адсорбируются на адсорбенте, имеющем на поверхности ионы или диполи, то вследствие электростатического взаимодей-

32
ствия молекулы адсорбтива могут ориентироваться в электростатическом поле адсорбента, то есть происходит ориентационное кулоновское взаимодействие. Обычно энергия индукционного Uинд и ориентационного Uop взаимодействия гораздо больше энергии дисперсионного взаимодействия Uдисп. Принимая во внимание вышеназванные эффекты, имеющие место при адсорбции, формулу энергии взаимодействия между двумя молекулами в газовой фазе можно записать так:
U = Uор + Uинд + Uдисп + Uот, |
(12) |
где Uот – энергия отталкивания.
Причиной адсорбции, близкой к физической, может быть также образование водородной связи. В частности, такая связь возникает при адсорбции на адсорбентах, содержащих на поверхности гидроксильные группы таких молекул, как молекулы воды, спиртов, аммиака, аминов.
Кроме межмолекулярных сил адсорбцию могут вызывать химические силы, возникающие в результате химических реакций, протекающих на границе раздела. Для них характерны большие тепловые эффекты, высокая скорость адсорбции.
Энергетические параметры адсорбции
Адсорбция является экзотермическим процессом, т. е. сопровождается убылью энтальпии ( Н < 0). Следовательно, согласно принципу Ле-Шателье, с повышением температуры адсорбция уменьшается. Для каждой температуры характерно свое состояние адсорбционного равновесия. Величина энтальпии, определенная для процесса адсорбции, называется энтальпией адсорбции ( H < 0) или теплотой адсорбции (Q > 0).
Фундаментальное адсорбционное уравнение Гиббса
В результате адсорбции происходит перераспределение компонентов между объемными фазами и поверхностным слоем, что влечет за собой изменение их химических потенциалов в системе, поэтому этот процесс можно рассматривать как превращение поверхностной энергии в химическую. Соотношение между поверхностным натяжением и химическими потенциалами выглядит следующим образом

|
|
|
33 |
|
|
U = T S + |
s + |
i ni, |
(13) |
где U – изменение внутренней энергии; Т – температура, К; |
S – изменение |
|||
энтропии; |
– поверхностное натяжение; i – химический |
потенциал i- |
||
компонента; ni – i-компонент; |
s – площадь соприкосновения. |
|
||
Все экстенсивные (неизменяющиеся) параметры (внутренняя энергия, энтропия, число молей компонентов) зависят от площади поверхности, поэтому удобнее относить эти параметры к единице площади поверхности. Разделив все члены уравнения на площадь поверхности, получаем
|
|
|
|
ni |
|
(14) |
|
|
|
S |
i |
||
|
|
|
|
|||
|
|
|
|
|
||
или |
|
|
|
|
|
|
|
|
|
ai d i , |
(15) |
||
где ai |
ni |
. |
|
|
|
|
|
|
|
|
|||
|
S |
|
|
|
||
Уравнение (15) называют фундаментальным адсорбционным уравнением Гиббса. Для разбавленных растворов
0 |
RT lnC , |
(16) |
i i |
где |
0 |
|
|
|
i |
– химический потенциал компонента 1 в исходном состоянии системы При T = const
i RT lnC . |
(17) |
Подставив уравнение (17) в уравнение (15) получим уравнение изотермы Гиббса
a |
C |
, |
(18) |
|
R T C |
||||
|
где а – адсорбция, – поверхностное натяжение, С – концентрация раствора Уравнение Гиббса показывает, что значение адсорбции будет положи-
тельным только при отрицательных значениях поверхностной активности (a > 0 при  / C < 0), т.е. когда поверхностное натяжение уменьшается с увеличением концентрации раствора; наоборот, адсорбция будет отрицательной, если поверхностная активность положительна (a < 0 при
/ C < 0), т.е. когда поверхностное натяжение уменьшается с увеличением концентрации раствора; наоборот, адсорбция будет отрицательной, если поверхностная активность положительна (a < 0 при 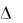 / C > 0), т.е. когда
/ C > 0), т.е. когда
34
с увеличением концентрации поверхностное натяжение увеличивается. И адсорбция отсутствует, когда поверхностное натяжение не изменяется с изменением концентрации (a = 0 при 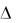 / C = 0).
/ C = 0).
а, 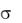
а
z
А
0 |
С1 |
С |
Рис. 10. Зависимости |
= f(С), а = f(с) |
|
Пользуясь уравнением Гиббса, легко построить изотерму адсорбции. Для этого устанавливают зависимость поверхностного натяжения от концентрации раствора, строят изотерму поверхностного натяжения (рис. 10). На полученной изотерме берут ряд точек, отвечающих равновесным концентрациям (например, точка А соответствует равновесной концентрации С1). Через эти точки проводят касательные до
пересечения с ординатой и прямые, параллельные оси абсцисс.
Из построения видно, что отношение отрезка z к отрезку абсциссы 0С1 равно поверхностной активности -  / С:
/ С:
z |
|
|
. |
(19) |
|
|
|
||
C |
C |
|||
1 |
|
|
|
|
Подставляя это значение в уравнение Гиббса, получим
a1 |
C1 |
|
|
|
z |
. |
(20) |
R T |
|
C R T |
|||||
|
|
|
|
||||
Таким образом, определив для ряда точек на изотерме поверхностного натяжения отрезки z, рассчитывают величину адсорбции и строят изотермы адсорбции (рис. 10).
Адсорбция на границе раздела твердое тело-газ
Теория адсорбции газов на твердом адсорбенте была разработана американским ученым И. Ленгмюром, который в своей теории исходил из моле- кулярно-кинетических представлений.

35
Теория Ленгмюра состоит из трех основных положений.
1.Поверхность каждого адсорбента дискретна. Адсорбция происходит не на всей поверхности адсорбента, а лишь на активных центрах. Число активных центров определяется числом молекул, атомов или ионов адсорбента с некомпенсированными межмолекулярными, межатомными или межионными силами, за счет которых и происходит адсорбция частиц адсорбата. Таким образом, природа адсорбционных сил близка к химической, т. е. обусловлена остаточными валентными силами.
2.Так как химические валентные силы не распространяются дальше чем на диаметр одной молекулы, то каждая нескомпенсированная молекула поверхности адсорбента может удержать только одну подвижную частицу адсорбата, т. е. адсорбат на поверхности адсорбента располагается мономолекулярным слоем.
3.В мономолекулярном слое молекулы адсорбата располагаются не в любых случайных положениях, а строго ориентированно к поверхности адсорбента.
При увеличении концентрации адсорбата происходит адсорбционное насыщение поверхности адсорбента, и молекулы приобретают вертикальную ориентацию, отвечающую наиболее плотной упаковке молекул с наибольшим значением адсорбции. Такие адсорбционные слои получили название конденсированных пленок или ―частокола Ленгмюра‖ (рис.11а).
|
|
|
|
а) |
|
|
б) |
Рис.11. |
Образование адсорбционных пленок: |
||
а – газообразной; б – конденсированной
При очень малых концентрациях адсорбата, когда поверхность адсорбента имеет много свободных центров, молекулы адсорбируемого вещества, находясь друг от друга на больших расстояниях, приобретают горизонтальную ориентацию, отвечающую наименьшей поверхностной энергии (рис.11б). Такой адсорбционный слой получил название газообразной пленки, а соответствующее состояние вещества – состояния двухмерного газа.

36
Уравнение изотермы адсорбции Ленгмюра
И. Ленгмюр, основываясь на положениях своей теории и на равенстве скоростей адсорбции и десорбции, вывел уравнение изотермы адсорбции.
Рассмотрим процесс адсорбции как реакцию между адсорбируемым веществом А и адсорбционными центрами поверхности М:
А(газ) + М (поверхность) АМ.
Пусть n1 – число молей газа, подошедших за одну секунду к поверхности адсорбента площадью 1 м2; – доля адсорбируемых молекул; n2 – число молекул, удаляющихся за одну секунду с 1 м2 площади поверхности адсорбента, полностью насыщенного молекулами адсорбтива; х – доля площади поверхности, занятой адсорбентом; (1 – х) – доля площади свободной поверхности.
Скорость адсорбции va, т. е. количество адсорбируемых молекул единицей площади поверхности в единицу времени:
va = n1 |
(l – x). |
(21) |
Скорость десорбции vд – есть количество молекул, десорбируемых с единицы площади поверхности в единицу времени:
vд = n2 х . |
(22) |
При достижении равновесия скорость адсорбции равна скорости десорбции:
va = vд или n1 (1 – х) = n2х. |
(23) |
Решив это уравнение относительно доли площади поверхности, занятой адсорбтивом, получим
x |
|
n1 |
|
. |
(24) |
|
|
|
|||
|
n2 |
|
n1 |
|
|
или после деления числителя и знаменателя на n2
x |
n1 |
/ n2 |
|
. |
(25) |
1 n |
/ n |
||||
|
|
|
|
|
|
|
1 |
|
2 |
|
|

37
Величина n1 пропорциональна давлению газа (по закону Генри):
n1 = k |
p. |
(26) |
||||
Подставляя это значение в уравнение (25) и заменяя |
k/n2 на К, получим |
|||||
x |
|
Kp |
|
|||
|
|
|
|
|
||
1 |
Kp , |
(27) |
||||
|
||||||
где K – константа адсорбционного равновесия, р – давление газа адсорбата.
Уравнение (27) называется уравнением изотермы адсорбции Ленгмюра относительно степени заполнения поверхности х.
Чтобы выразить адсорбцию в молях, введем величину N – общее количество активных центров на 1м2 площади поверхности. Так как каждый центр удерживает одну молекулу, то количество адсорбированных молекул будет равно Nx. В то же время количество адсорбированных молекул можно представить как aNo (где No – число Авогадро). Тогда
aNo = Nx, |
(28) |
||
a |
N |
x . |
(29) |
|
|||
|
N0 |
|
|
Отношение N/No представляет собой максимальную адсорбцию вещества в молях на площади поверхности 1 м2. Обозначив N/No через amax и подставив значение х из уравнения (27) в уравнение (29), получим
Kp |
|
a amax 1 Kp . |
(30) |
Уравнение (30) является также уравнением изотермы адсорбции Ленгмюра, связывающим количество адсорбируемого вещества с равновесным давлением. Это уравнение выведено И. Ленгмюром для случая адсорбции газа на гладкой твердой поверхности. Однако оно применимо для расчета адсорбции на любой поверхности раздела. В случае адсорбции из раствора уравнение Ленгмюра имеет вид
a amax |
|
|
K C |
. |
(31) |
1 |
|
||||
|
K C |
|
|||
38
где a – адсорбция; amax – предельная адсорбция адсорбента; K – константа адсорбционного равновесия; C – равновесная концентрация адсорбтива.
Постоянная amax (кмоль/м2) означает предельную адсорбцию адсорбента и соответствует полному заполнению газом или молекулами раствора активных центров адсорбента.
Величина К – константа адсорбционного равновесия вещества между поверхностью и газовой фазой или поверхностью и жидкой фазой, характеризует энергию взаимодействия адсорбтива с адсорбентом. Чем сильнее это взаимодействие, тем больше константа адсорбционного равновесия.
Таким образом, все константы уравнения Ленгмюра имеют определенный физический смысл.
Графически изотерма адсорбции Ленгмюра аналогична изотерме Гиббса (рис.9). Она показывает:
1)при С 0, т. е. при малых концентрациях адсорбтива адсорбция увеличивается пропорционально концентрации;
2)при C  , a = amax, т.е. наступает предельное адсорбционное насыщение адсорбтивом поверхности адсорбента и дальнейшее увеличение концентрации почти не изменяет величины адсорбции.
, a = amax, т.е. наступает предельное адсорбционное насыщение адсорбтивом поверхности адсорбента и дальнейшее увеличение концентрации почти не изменяет величины адсорбции.
Для решения уравнения Ленгмюра, т.е. для определения постоянных amax
иК, используется графический метод. С этой целью уравнение Ленгмюра преобразуется следующим образом:
1 |
|
Kc |
1 |
, |
(32) |
|
|
|
|
||
a |
|
amax |
Kc |
затем уравнение (32) преобразуется
1 |
1 |
1 |
, |
(33) |
||
|
|
|
|
|
||
a |
|
amax |
|
amax k C |
||
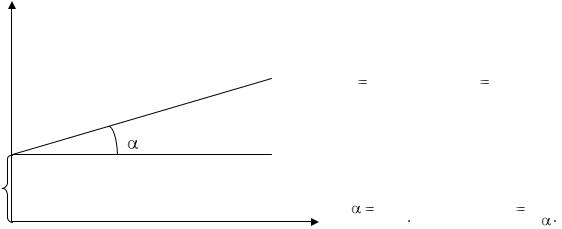
Графически изотерма адсорбции по уравнению (33) имеет линейный вид и приведена на рис .12.
39
1/а
b
1/аmax
a
0
Рис.12.
На оси ординат отсекается
отрезок ab, равный 1/ аmax. Вели- |
|||||
чину аmax получаем из уравнения |
|||||
d |
1 |
, т.е. a |
|
1 |
. Константа |
ab |
|
||||
|
max |
|
|||
|
amax |
ab |
|||
|
|
||||
равновесия K определяется графически как тангенс угла наклона прямой bd к оси абсцисс.
tg |
1 |
, отсюда k |
1 |
. |
|
|
|||
amax K |
tg amax |
|||
1/С |
|
|
|
|
Изотерма адсорбции Ленгмюра в линейной форме
Адсорбция находит широкое применение во многих технологических процессах. На различной способности компонентов смеси к адсорбции основаны методы разделения и анализа многокомпонентных систем (адсорбционная, распределительная, ионообменная хроматография).
Особенно актуально использование явления адсорбции в решении экологических задач, в частности, для очистки газов и жидкостей от различных примесей, при подготовке питьевой воды, очистке сточных вод и газовых выбросов промышленных производств, в том числе мебельных и деревообрабатывающих предприятий.
На явлении адсорбции основаны широко распространенные в деревообработке такие технологические операции, как лакирование, окрашивание, склеивание и др.
Экспериментальная часть
Реактивы и оборудование: адсорбенты: активированный уголь, цеолит, силикагель, глинистый минерал и др.; растворы метилового оранжевого; фотоэлектроколориметр; весы; разновесы; стаканы химические емкостью 50 мл; конические колбы; воронки; фильтровальная бумага.
Опыт 1. Адсорбция метилового оранжевого различными адсорбентами
Цель опыта: ознакомление с теорией адсорбции и экспериментальное определение адсорбционных характеристик различных адсорбентов при адсорбции метилового оранжевого.
