
химия лабораторный практикум
.pdf
90
Полиформальдегид [− СН2 − O −]n – белый твердый материал, химически весьма устойчивый. Применяется для изготовления деталей различных механизмов и машин.
Синтетические каучуки (эластомеры) при вулканизации превращаются в резину, для которой характерна высокая эластичность. Промышленность выпускает большое число различных синтетических каучуков (СК), свойства которых зависят от типа мономеров. Резины используют для производства шин, защитных оболочек кабелей и проводов и т.д.
Из СК получают эбонит, широко используемый в электротехнике. Резины, получаемые из СК специального назначения, кроме эластичности характеризуются, например, бензо- и маслостойкостью (бутадиен-нитрильный СК), бензо-, масло- и теплостойкостью, негорючестью (хлоропреновый СК), износостойкостью (полиуретановый СК и др.).
Феноло-амино-формальдегидные смолы получают поликонденсацией формальдегида с фенолами и аминами. Их используют как основу клеев, лаков, ионитов и пластмасс. Пластмассы на основе фенолоформальдегидных смол называются фенопласты, на основе карбамидоформальдегидных смол – аминопласты. Фенопласты устойчивы к действию воды, растворов кислот, солей и оснований, органических растворителей, трудногорючи, атмосферостойки, хорошие диэлектрики. Используются в производстве печатных плат, корпусов электротехнических и радиотехнических изделий. Аминопласты имеют высокие диэлектрические и физико-химические свойства, устойчивы к действию света и УФ-лучей, трудногорючи, стойки к действию слабых кислот и оснований и многих растворителей, хорошо окрашиваются в разные цвета. Применяются для изготовления электротехнических изделий, корпусов приборов и аппаратуры, выключателей тепло- и звукоизоляционных материалов и др. В деревообрабатывающей и мебельной промышленности их используют в каче-
стве связующих в композициях |
лаков, красок, эмалей, клеев, пропитывающих |
|||
составов. |
|
|
|
|
Кремнийорганические полимеры (силиконы) содержат атомы кремния в |
||||
элементарных звеньях макромолекул, например: |
|
|||
R |
|
|
R |
|
| |
|
|
| |
|
− O − Si − |
|
или |
− Si − R − |
|
| |
n |
|
| |
n . |
R |
|
|
R |
|
91
Полимеры, в состав которых не входят атомы углерода, получили название неорганических. Среди неорганических полимеров много природных типа полисиликатов. В настоящее время широко ведутся исследования с целью получения синтетических неорганических полимеров. К неорганическим полимерам относятся: аморфный диоксид кремния [SiО2]n, поликремниевая кислота [nSiО2 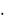 m
m 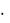 Н2О], природные и синтетические силикаты, полифосфорные кислоты, полифосфаты. Важным свойством некоторых неорганических полимеров является полупроводимость.
Н2О], природные и синтетические силикаты, полифосфорные кислоты, полифосфаты. Важным свойством некоторых неорганических полимеров является полупроводимость.
Характерной особенностью кремнийорганических полимеров является высокая тепло- и морозостойкость, эластичность. Кремнийорганические полимеры используются для получения лаков, клеев, пластмассы и резины. Резины, получаемые на основе кремнийорганических каучуков [-Si(R2)-O-]n, могут эксплуатироваться при температуре от - 90 до +300 °С, обладают атмосферостойкостью, высокими электроизоляционными свойствами. Применяются для изделий, работающих в условиях большого перепада температур, например, для защитных покрытий космических аппаратов, холодильных аппаратов и т.д.
Экспериментальная часть
Опыт 1. Растворимость пластмасс
Целлулоид – это натуральный полимер. В качестве растворителей полимеров применяют жидкие органические углеводороды – бензин, керосин, петролейный эфир, а также спирты, кетоны, например, ацетон; эфиры, например, бутилацетат, этилацетат и др.
Порядок проведения эксперимента. Налейте в пробирку 3-4 мл ацето-
на и при помешивании стеклянной палочкой растворите несколько кусочков целлулоида. Когда раствор станет вязким, смочите им ватку и протрите часовое стекло или натрите гладкий кусочек дерева. После улетучивания ацетона наблюдайте образование пленки на часовом стекле, а на кусочке дерева появление слоя лака.
Два кусочка целлулоида смочите с концов ацетоном и через 1-2 мин наложите их концы друг на друга и слегка сдавите. После высыхания они прочно склеиваются.
Запишите данные опыта. Отметьте наблюдаемые явления.

92
Опыт 2. Отверждение эпоксидной смолы
Порядок проведения эксперимента
Приготовление клеевой композиции на основе эпоксидной смолы
Полимерную банку с эпоксидной смолой погружают на 7-10 мин в сосуд с водой, температура которой 80-90 °С. В фарфоровой чашке взвешивают 3 г эпоксидной смолы и в остывшую смолу добавляют 0,8 г отвердителя, содержащего полиэтиленполиамин с пластификатором. Композицию тщательно перемешивают, и она пригодна к применению в течение 30 мин с момента введения отвердителя.
Склеивание деталей эпоксидным клеем
Вначале необходимо подготовить поверхности склеивания, для этого шлифовальной шкуркой поверхность детали следует зачистить, затем протереть бумагой или ветошью, смоченной в бензине или ацетоне, подсушить. Клеевая композиция наносится на подготовленную поверхность шпателем или любой пластинкой слоем толщиной не менее 2 мм. Склеиваемые детали следует закрепить на время отверждения, нагрузка не должна превышать 3 кг/см2, время отверждения композиции при температуре 18 °С – 16 ч.
Запишите данные опыта. Отметьте наблюдаемые явления.
Опыт 3. Определение температуры размягчения полимера
Один из методов определения температуры размягчения полимера получил название "кольцо-шар". Метод связан с расплавлением полимера до жидкого состояния, поэтому пригоден лишь для испытаний низкомолекулярных полимеров.
Прибор для определения температуры размягчения (рис. 1) состоит из двух стаканов, входящих один в другой. Наружный стакан, заполняемый глицерином, служит термостатом. Во внутренний стакан помещают латунный штатив с двумя пластинками. Верхняя пластинка 1 имеет три отверстия, два из них предназначены для колец 4, в которые входят шарики 3, и одно – для термометра 5. Нижняя пластинка 2 служит для смягчения удара при падении шарика.

93
Рис. 1. Внутренний стакан прибора для определения температуры размягчения:
1 - верхняя пластинка;
2 - нижняя пластинка; 3 - шарик; 4 - кольцо; 5 - термометр.
Порядок проведения эксперимента. Кольца помещают на стеклянную или металлическую пластинку и заливают до краев расплавленным полимером. После охлаждения избыток полимера срезают горячим ножом и, установив на эту поверхность шарики, переносят кольца на пластинку 1.
Штатив помещают в стакан и нагревают глицериновую баню со скоростью 1 °С в минуту. По термометру отмечают температуру, при которой шарик, провисая в слое полимера, коснется поверхности нижней пластинки.
Запишите данные опыта. Объясните наблюдаемые явления. Отметьте температуру размягчения полимера.
Опыт 4. Определение показателя условной вязкости полимера
Показателем условной вязкости называют время истечения определенного объема смолы через калибровочное сопло стандартной воронки прибора. Для этой цели используют вискозиметры ВЗ-1, ВЗ-4, выпускаемые по ГОСТ 9070-75. Диаметр сопла вискозиметра ВЗ-1 – 5,4 мм, вискозиметра ВЗ-4 – 4,4 мм. Форма воронки вискозиметра ВЗ-4 приведена на рис. 2.
Порядок проведения эксперимента
Ход работы на вискозиметре ВЗ-4 Устанавливают вискозиметр ВЗ-4 в горизонтальном положении. Под со-
пло ставят мерный сосуд (цилиндр, мензурку) емкостью 100 мл. Отверстие сопла снизу закрывают пальцем. В вискозиметр с избытком наливают смолу так, чтобы образовался выпуклый мениск над верхним ею краем. Избыток смолы и образовавшиеся пузырьки воздуха удаляют стеклянной палочкой, сдвигая их по верхнему краю вискозиметра в горизонтальном направлении, затем закрывают отверстие сопла и одновременно с появлением смолы включают секун-

94
домер. Когда смола в мензурке достигнет точно уровня метки 100 мм, секундомер останавливают и отсчитывают время истечения с погрешностью не более 0,2 с. Определение повторяют три раза.
85
Рис.2. Форма воронки вискозиметра ВЗ-4: 50 1 – резервуар;
2 – желобок кольцевой;
3 – сопло
За величину условной вязкости X (С), определенной по ВЗ-1 или ВЗ-4, принимают среднее арифметическое трех параллельных определений и вычисляют по формуле
X = t 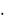 K,
K,
где t – среднее арифметическое значение времени истечения смолы, с;
К – поправочный коэффициент вискозиметра, указанный в паспорте прибора. Приготовить несколько растворов полимеров разной степени разбавления и для каждого раствора определить показатель условной вязкости. Полу-
ченные данные занесите в табл. 1.
Таблица 1
Условная вязкость полимеров разной степени разбавления
Номер |
Степень разбавления |
Время истечения |
Условная вязкость |
варианта |
полимера |
t, с |
полимера |
|
|
|
|
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
На основании полученных результатов сделайте вывод о зависимости условной вязкости полимера от степени его разбавления.
Вопросы для самоконтроля и повторения
95
1.Какие вещества называются полимерами?
2.Укажите на признаки, отличающие полимеры от низкомолекулярных соединений.
3.Что называется степенью полимеризации, элементарным звеном полимера? Как они связаны с молекулярной массой полимера?
4.Приведите основные признаки классификации полимеров.
5.Какие Вы знаете методы определения молекулярной массы полимера?
6.Охарактеризуйте основные методы получения полимеров.
7.В каких фазовых и физических состояниях существуют аморфные и кристаллические полимеры?
8.Охарактеризуйте основные материалы, получаемые на основе полимеров, и области их использования.
КОМПЬЮТЕРИЗИРОВАННЫЕ ЛАБОРАТОРНЫЕ РАБОТЫ
Лабораторная работа № 8
ТЕРМОХИМИЯ
Опыт 1. Определение теплоты растворения хорошо растворимых солей Цель опыта: определить теплоту растворения неизвестной соли. Для этого
необходимо:
-определить изменение температуры при растворении известной соли;
-определить интегральную теплоту растворения данной соли (по справочнику);
-рассчитать постоянную калориметра;
-определить ∆T при растворении неизвестной соли;
-рассчитать интегральную теплоту растворения неизвестной соли.
Теоретическая часть
Теплота растворения твердого соединения с ионной кристаллической решеткой определяется в основном суммой двух величин: теплоты разрушения кристаллической решетки и теплоты сольватации ионов молекулами растворителя. В связи с тем, что на разрушение кристаллической решетки теплота затрачивается, а процесс сольватации сопровождается выделением теплоты, знак теплоты растворения может оказаться как положительным, так и отрица-

96
тельным, в зависимости от того, какое из двух слагаемых больше по абсолютной величине.
Теплота растворения зависит от концентрации образующегося раствора. Например, при растворении одного моль CuCO3 · 2 H2O в 8 моль воды поглощается 3,35 кДж теплоты, при растворении того же количества кристаллогидрата в 12 молях воды теплота растворения равна нулю, а при растворении в очень большом количестве воды выделяется 17,67 кДж теплоты.
Различают интегральную и дифференциальную теплоты растворения. Теплота, которая поглощается или выделяется при растворении одного моль вещества в таком количестве растворителя, чтобы образовался раствор с определенной моляльностью m, называется интегральной теплотой растворения. Дифференциальной теплотой растворения называется тепловой эффект, сопровождающий процесс растворения одного моль вещества в бесконечно большом количестве растворителя.
Дифференциальные теплоты растворения определяются расчетным методом. Интегральные теплоты растворения находятся экспериментально.
Рекомендации по проведению расчетов
Расчет теплоты растворения проводят на основе уравнения теплового баланса
Q ( m1 m2 )c mi ci T , |
(1) |
где m1 и m2 – масса воды и соли, соответственно, г;
с– теплоемкость образующегося раствора, Дж г-1 К-1, (для водных растворов
снебольшой концентрацией растворенного вещества можно принять, что с = 4,18 Дж г-1 К-1); mi и сi – масса и теплоемкость составных частей калориметра.
К-1); mi и сi – масса и теплоемкость составных частей калориметра.
Точно определить mi и сi не представляется возможным. Поэтому ∑miсi обозначают символом К, называемым постоянной калориметра и определяют его значение по изменению температуры при растворении определенного количества соли с известной теплотой растворения. Постоянная калориметра - количество тепла, которое необходимо подвести к участвующей в теплообмене части калориметра, чтобы поднять его температуру на 1°С. В этом случае
уравнение теплового баланса запишется в виде: |
|
Q = [(m1+m2)c + K] ∆Т. |
(2) |
Отсюда |
|
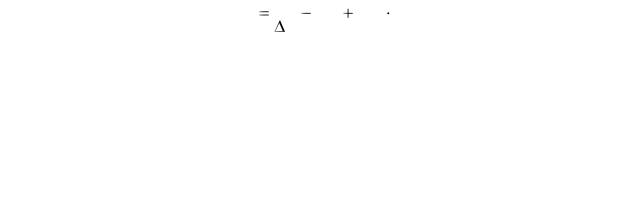
97
K |
Q |
( m1 |
m2 ) c . |
(3) |
|
|
|||||
T |
|||||
|
|
|
|
Вкачестве соли с известной теплотой растворения можно использовать КСl или NH4Cl. Интегральные теплоты растворения солей даны в справочнике.
Всправочнике интегральные теплоты растворения даны для стандартной температуры 298 К. Если температура воды, в которой растворяют соль, отличается от стандартной, то теплота растворения будет иной. Поэтому опыт нужно проводить при стандартной температуре или рассчитывать интегральную теплоту растворения для данной температуры с помощью уравнений типа ∆H =∆H298k (298 – T), где k – коэффициент, характерный для каждой соли. На-
пример, для КСl – ∆Hуд = 256,9 – 3,89(298 - T), Дж  г-1.
г-1.
Теплота растворения соли зависит от концентрации образующегося раствора. Поэтому необходимо рассчитать концентрацию раствора, образующегося при растворении соли с известной теплотой растворения и, в соответствии с этим, интерполяцией определить теплоту растворения этой соли для данной концентрации, а затем рассчитать постоянную калориметра.
Зная постоянную калориметра легко рассчитать теплоту растворения неизвестной соли. Для этого определяют изменение температуры при растворении неизвестной соли и рассчитывают Q по формуле, а также рассчитывают удельную теплоту растворения неизвестной соли q по формуле
q = Q / m2. |
(4) |
Значение удельной теплоты растворения соли можно использовать (наряду с другими данными) для определения соли. Для этого сравнивают полученное значение со справочными значениями удельных теплот растворения различных солей.
Экспериментальная часть
Приборы и реактивы
1.Учебно-лабораторный комплекс «Химия» в следующей комплектации: - центральный контроллер;
- модуль «Термостат» в комплекте со стеклянным стаканчиком (150 см3), термодатчиком и устройством для размещения навески соли в термостате.
2.Навеска соли с известной теплотой растворения (2 г) и навеска неизвестной соли (2 г).

98
Порядок проведения эксперимента
Для экспериментального определения теплоты растворения неизвестной соли вначале определяют постоянную калориметра. Для этого стакан, в который налито 100 см3 дистиллированной воды, устанавливают в калориметр и закрывают крышкой с укрепленным в ней датчиком температуры. В отверстие крышки вставляют специальную пробирку, в которую предварительно насыпано 2 г измельченной соли с известной теплотой растворения (КСl или NH4Cl). Подключение термостата к контроллеру, подключение термодатчика, включение перемешивания и измерение температуры в ходе опыта проводят согласно параграфу «Управление УЛК с помощью компьютера». Проводят растворение соли по методике, описанной в п. «Получение температурных данных». Графическим методом определяют изменение температуры при растворении соли и рассчитывают постоянную калориметра. Затем выливают из стакана раствор, ополаскивают дистиллированной водой, наливают в него 100 см3 дистиллированной воды и устанавливают в калориметр. Затем проводят растворение 2 г неизвестной соли аналогично растворению соли с известной теплотой растворения, определяют изменение температуры и рассчитывают интегральную теплоту растворения.
Пример расчета теплоты растворения неизвестной соли
Исходные данные. Для определения постоянной калориметра, в 500 см3 воды растворялось 5 г NH4Cl. Действительное изменение температуры, определенное графическим методом, составило 0,6 °С. При растворении 5 г неизвестной соли, действительное изменение температуры составило 0,68 °С. Температура воды равна 25 °С.
Определение постоянной калориметра Определим моляльную концентрацию раствора, образующегося при рас-
творении 5 г NH4Cl.
Молярная масса NH4Cl - М = 53,5 г/моль. 5 г NH4Cl составляет 5/53,5 = 0,0935 молей. В 500 г воды растворили 0,0935 моль, а в 1000 г будет растворено 0,187 моль. Следовательно, моляльность т = 0,187 моль кг-1.
Всправочнике для NH4Cl даны интегральные теплоты растворения: при
т= 0,1 моль кг-1, ∆Hт = 15,1 кДж/моль и при m = 0,2, ∆Hт = 15,19 кДж/моль. Методом интерполяции определяем интегральную теплоту растворения для

99
т = 0,187 моль кг-1. Увеличение ∆Hт при увеличении моляльности на 0,1 моль кг-1 составляет 15,19 – 15,1 = 0,09 кДж/моль. Для увеличения моляльности на 0,187 – 0,1 = 0,087 моль кг-1 увеличение ∆Hт составит 0,09 0,087/0,1 =
=0,0783 кДж/моль. Отсюда, интегральная теплота растворения NH4Cl, при образовании раствора с т = 0,187 моль кг-1 равно 15,1+0,0783 = 15,1873кДж/моль
=15,1873 / 53,5 = 284 Дж/г.
При растворении 5 г NH4Cl поглотилось Q = 284  5 = 1,42 кДж теплоты. Теплоемкость раствора приближенно равна 4,18 Дж г-1 К-1.
5 = 1,42 кДж теплоты. Теплоемкость раствора приближенно равна 4,18 Дж г-1 К-1.
K |
Q |
( m1 m2 ) c = |
1420 |
- (500+5) · 4,18 = 255,76. |
||
|
|
0,6 |
|
|||
T |
|
|||||
|
|
|
|
|||
Определение теплоты растворения неизвестной соли
Q = [(m1+ m2) с + K] ∆T = [(500 + 5) ·4,18 + 255,76] · 0,68 = 1609,32Дж.
Удельная теплота растворения неизвестной соли q = 1609,32 / 5 = 321,86 Дж/г.
В справочнике приведены интегральные теплоты растворения различных солей в кДж/моль. Так как молярная масса соли неизвестна, то пересчитываем молярные интегральные теплоты растворения на удельные.
Так для КI - q = 125,5 Дж/г, для NaСl - q = 73 Дж/г, для NH4NO3 - q = 321,87 Дж/г.
Сравнивая значение удельной теплоты растворения, определенной экспериментально, с табличными данными, можно предположить, что неизвестная соль - NH4NO3.
Опыт 2. Определение теплоты нейтрализации сильной кислоты сильным основанием
Цель опыта: определить теплоту нейтрализации сильной кислоты сильным основанием. Для этого необходимо:
-определить постоянную калориметра;
-определить теплоту нейтрализации и разведения (смешения);
-определить теплоту разведения кислоты.
Теоретическая часть
