
- •2.2. Условная константа устойчивости комплексонатов при заданном рН
- •2.3. Условная константа устойчивости комплексонатов при дополнительном
- •Расчет кривой комплексонометрического титрования
- •Индикаторная погрешность при комплексонометрическом титровании
- •6. Комплексонометрическое титрование смеси металлов
- •7. Способы комплексонометрического титрования
- •0,1% Спиртовый раствор индикатора пан;
- •0,1% Спиртовый раствор индикатора ко;
- •6 М раствор гидроксида натрия;
Реферат на тему: Комплексонометрическое титрование . Сущность и химизм
Метода
Манапов М.М ТИ-4
ВВЕДЕНИЕ
Метод комплексонометрического титрования (комплексонометрия) основан на реакции образования внутрикомплексных соединений ионов металлов со специальными комплексообразующими органическими реагентами – комплексонами, в частности, аминополикарбоновыми кислотами и их солями. Комплексоны образуют с ионами металлов прочные комплексы состава 1:1 (комплексонаты), что исключает ступенчатое комплексообразование и упрощает анализ и сопутствующие ему расчеты. Метод комплексонометрического титрования обладает высокой чувствительностью (до 10-3 моль/л) и точностью (погрешность 0,1-0,3%), быстр и прост в исполнении, имеет достаточно высокую избирательность (селективность), что обеспечило его широкое применение в практике химического анализа.
В фармации комплексонометрическое титрование используют для количественного определения препаратов кальция (хлорид, глюконат, лактат и др.), цинка (оксид и сульфат, цинк-инсулин), железа (глицерофосфат, лактат, сахарат, аскорбинат, сульфат и др.), кобальта (цианкобламин, коамид, ферковен), препаратов, содержащих соли магния, висмута, ртути, свинца и других металлов Широко применяют комплексонометрию при анализе воды, в частности, при определении её жесткости, обусловленную присутствием солей кальция и магния. При анализе различных минералов и растительного сырья метод комплексонометрического титрования позволяет проводить определение разных элементов при их совместном присутствии. Большое значение комплексонометрия имеет при анализе промышленных отходов и сточных вод, а также при определении экологической чистоты природных объектов. Косвенной комплексонометрией методами обратного и заместительного титрования можно определять анионы (сульфаты, фосфаты, арсенаты, оксалаты и др.), образующие малорастворимые соединения с катионами, титруемыми комплексонами.
Настоящие методические указания являются переработанным и дополненным изданием указаний, существующих на кафедре аналитической химии СПХФА (Комплексонометрическое титрование. Методические указания / Сост. А.И.Стеценко. СПб.: СПХФА, 1992.- 39 с.).
I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОМПЛЕКСОНОМЕТРИЧЕСКОГО
ТИТРОВАНИЯ
-
Комплексоны и их свойства
Комплексоны – это специальные органические комплексообразующие реагенты класса аминополикарбоновых кислот, которые являются полидентатными лигандами, связывающие ионы металлов по типу внутрикомплексных солей и широко применяемые в качестве титрантов при количественном определении металлов. Впервые использовать комплексоны в аналитической химии предложил в 1949 г. швейцарский ученый Г.Шварценбах.
Простейшим комплексоном является нитрилотриуксусная кислота (комплексон , H3Y):

Комплексон взаимодействует с ионами металлов в молярном соотношении 1:1 и способен образовывать с металлом четыре связи, одна из которых носит донорно-акцепторный характер за счет неподеленной электронной пары атома азота, а три другие ионный – за счет замещения трех ионов водорода карбоксильных групп на ион металла:
Mn++ H3Y MYn-3+ 3H+
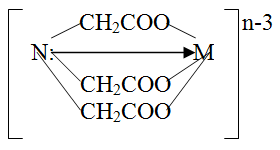
Анион нитрилотриуксусной кислоты при этом четырехдентатен, а комплекс его с металлом (комплексонат) имеет тетраэдрическое строение.
Наиболее распространенными комплексонами являются слабая четырехосновная этилендиаминтетрауксусная кислота (комплексон , ЭДТУК, H4Y) и дигидрат её динатриевой соли (комплексон , ЭДТА, Na2H2Y·2H2O, торговое название «Трилон Б»):

Четырехзарядный анион этилендиаминтетрауксусной кислоты (Y4-) способен образовывать с ионами металлов шесть связей (шестидентатный лиганд), две из которых за счет атомов азота и четыре – за счет ацетатных групп. С двух-, трех- и четырехзаряженными ионами металлов анион Y4- образует тетраэдрические (Ca2+, Mg2+, Ba2+) и октаэдрические комплексы (комплексонаты) состава MYn-4, где n – заряд иона металла.
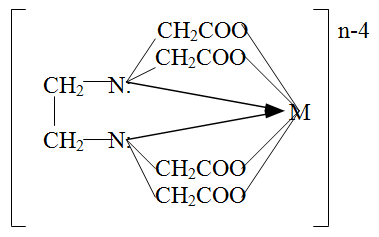
Комплексонаты практически всех металлов бесцветны и хорошо растворимы в воде.
При комплексонометрическом титровании чаще применяют двунатриевую соль этилендиаминтетрауксусной кислоты (трилон Б), так как она значительно лучше растворима в воде, чем сама кислота. Эта соль образуется в реакции нейтрализации кислоты щелочью:
H4Y + 2NaOH Na2H2Y + 2H2O
Такое течение реакции обусловлено тем, что константы двух первых ступеней диссоциации этилендиаминтетрауксусной кислоты значительно превосходят последующие ступенчатые константы диссоциации: Ka1= 1·10-2(pKa1= 2,0), Ka2= 2,1·10-3(pKa2= 2,7), Ka3= 6,9·10-7(pKa3= 6,2), Ka4= 5,5·10-11(pKa4= 10,3). Близкие значения Ka1и Ka2 и их большое отличие от последующих констант диссоциации связано с бетаиновой структурой кислоты:
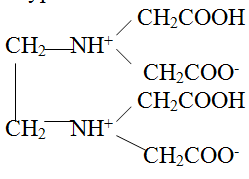
Из величин ступенчатых констант диссоциации следует, что этилендиаминтетрауксусная кислота (H4Y) в нейтральной среде существует преимущественно в виде анионов H2Y2-. По мере увеличения рН раствора образуются ионы HY3- и Y4-, причем последние преобладают в сильно щелочной среде при рН > 11.
В практике комплексонометрического титрования основным рабочим раствором является раствор дигидрата динатриевой соли этилендиаминтетрауксусной кислоты, которая выпускается промышленностью под торговым названием «трилон Б» со степенью очистки «ХЧ» (химически чистый) или «ЧДА» (чистый для анализа). Трилон Б хорошо растворим в воде и его растворы устойчивы при хранении. Рабочий раствор трилона Б можно готовить по точной навеске (с учетом влажности образца), однако обычно его точную концентрацию определяют по стандартному раствору сульфата цинка (см. разд., раб.1), который получают растворением точной навески металлического цинка в серной кислоте.
Исходя из всего выше сказанного, реакция между ионом металла и трилоном Б может быть записана в следующем виде:
Mn++ H2Y2- MYn-4+ 2H+
При этом следует отметить ряд особенностей протекания реакции, благодаря которым комплексонометрия получила широкое применение в химическом анализе:
-
в результате реакции образуются комплексы только одного состава с соотношением металл:лиганд равным 1:1 (комплексонаты); при этом комплексонаты бесцветны, хорошо растворимы в воде и обладают высокой устойчивостью, так как центральный атом металла прочно связан полидентатным хелатным лигандом;
-
реакция является обратимым процессом и может быть сдвинута как в сторону образования, так и в сторону разрушения комплексоната, что легко достигается с помощью варьирования величины рН раствора – подкисление приводит к смещению равновесия влево к исходным реагентам, а подщелачивание способствует образованию комплексоната;
-
в результате реакции выделяются ионы водорода, поэтому её следует проводить в буферной среде, поддерживая оптимальное значение рН, определяемое константой устойчивости комплексоната.
2. Устойчивость комплексонатов металлов в водных растворах
При практическом применении комплексонометрического титрования важно знать насколько полно протекает реакция комплексообразования в тех или иных условиях, в первую в среде с определенным значением рН и в присутствии других лигандов, способных образовывать комплексы с определяемым металлом. Такую оценку осуществляют с помощью истинных и условных констант устойчивости (образования).
2.1. Истинная константа устойчивости комплексонатов
В реакции комплексообразования ионов металла с комплексоном участвует только полностью ионизированная форма Y4-:
Mn++ Y4- MYn-4
Константа этого равновесия, выраженная через концентрации реагирующих и образующихся частиц, называется истинной концентрационной константой образования или устойчивости комплексоната K (или ):
![]() (2.1)
(2.1)
Концентрационная константа устойчивости комплексоната не зависит от концентрации участников реакции и величины рН раствора. Величина константы, а следовательно, устойчивость комплексоната, определяется природой иона металла, его зарядом, радиусом и электронным строением, ионной силой раствора, природой растворителя и температурой. Чем больше константа, тем более устойчив комплексонат. В табл.1 приведены численные значения логарифмов констант устойчивости комплексонатов некоторых металлов с ЭДТА в водном растворе при 200С и ионной силе 0,1.
Таблица 1
Логарифмы констант устойчивости комплексонатов с ЭДТА в водном растворе
при 200С и ионной силе 0,1.
|
Ионы
|
lgK(MYn-4) |
Ионы |
lgK(MYn-4) |
|
Ba2+ Mg2+ Ca2+ Fe2+ Al3+ Co2+ Ce3+ Cd2+ Zn2+ Pb2+ |
7,8 8,7 10,7 14,3 16,1 16,3 16,4 16,5 16,5 18,0 |
Ni2+ Cu2+ Hg2+ Cr3+ Th4+ Ce4+ Fe3+ U4+ Bi3+ Zr4+ |
18,6 18,8 21,8 23,0 23,0 24,2 25,1 25,2 27,9 29,5 |
Наибольшими константами устойчивости характеризуются комплексонаты многозарядных, небольших по размеру ионов p- и d-элементов (Zr4+, Bi3+, Fe3+, Ce4+ и др.) (табл.1). Однако, силы взаимодействия между центральным атомом и анионом комплексона Y4- не являются чисто электростатическими, так как имеет место ковалентное донорно-акцепторное взаимодействие иона металла с неподеленной электронной парой атома азота, да и взаимодействие иона металла с карбоксилатной группой лиганда не носит чисто ионный характер, а сопровождается поляризационными эффектами. Увеличение устойчивости комплексонатов обусловлено и так называемым хелатным эффектом, связанным с образованием в комплексе прочных 5- и 6-членных циклов. Ценным свойством ЭДТА является способность образовывать достаточно прочные комплексы с ионами щелочноземельных металлов (s-элементы) – Ba2+, Mg2+, Ca2+, перевод которых в комплексные соединения другими реагентами практически невозможен.
Реакция комплексообразования может быть использована в количественном анализе необходимо, если она протекает с достаточной полнотой, то есть на 99,99%. При этом в точке эквивалентности остаточные концентрации [Mn+] и [Y4-] составляют 0,01% от исходной концентрации (или 1·10-4 от единицы). Тогда по уравнению (2.1) имеем:
![]()
Это означает, что количественное комплексонометрическое определение металла возможно, если константа устойчивости комплексоната не менее 108. Однако, кислотность среды и дополнительные комплексообразователи сильно влияют на образование комплекса MYn-4, что учитывают с помощью условных констант устойчивости. Знание их величин дает возможность ответить на вопрос, возможно ли комплексонометрическое определение данного иона металла с требуемой точностью в данной конкретной среде.
2.2. Условная константа устойчивости комплексонатов при заданном рН
Влияние рН среды при комплексонометрическом титровании учитывают с помощью коэффициента конкурирующей реакции (Y4-), отражающего протонирование лиганда Y4- и представляющего собой мольную долю ионов Y4- в общей концентрации несвязанного с металлом комплексона C(Y), находящегося в различных формах протонирования C(Y) = [H4Y] + [H3Y-] + [H2Y2-] + [HY3-] + [Y4-] :
![]() ,
откуда [Y4-]
= C(Y)·(Y4-)
(2.2)
,
откуда [Y4-]
= C(Y)·(Y4-)
(2.2)
Значения (Y4-) при различных значениях рН приведены в табл.2.
Таблица 2
Значения (Y4-) для ЭДТА в водных растворах при различных рН
|
РН
|
(Y4-) |
pH |
(Y4-) |
|
1,0 2,0 3,0 4,0 5,0 6,0 7,0 |
5,7·10-18 3,7·10-14 2,5·10-11 3,6·10-9 3,5·10-7 2,2·10-5 4,8·10-4 |
8,0 9,0 10,0 11,0 12,0 13,0 14,0 |
5,4·10-3 5,2·10-2 3,5·10-1 8,5·10-1 9,8·10-1 1,0 1,0 |
Как и следовало ожидать, величина (Y4-), то есть мольная доля ионов Y4-, возрастает с увеличением рН раствора. Для промежуточных значений рН величина (Y4-) может быть рассчитана по известной формуле:
![]() (2.2’)
(2.2’)
Преобразуем уравнение (2.1), подставив вместо [Y4-] её выражение из (2.2):
![]() ,
,
откуда ![]() (2.3)
(2.3)
Величина K’ называется условной константой устойчивости и она, в отличие от истинной концентрационной константы, зависит от величины рН раствора.
Зная значения концентрационной константы устойчивости (табл.1) и коэффициента (Y4-) при заданном рН (табл.2), можно рассчитать величину условной константы устойчивости комплексоната (2.3) и, сравнив её с 108, сделать заключение о возможности количественного комплексонометрического определения металла в данной среде.
Пример 1. Оценить, возможно ли количественно комплексонометрически оттитровать раствором трилона Б ионы никеля и кальция при: а) рН=5; б) рН=9.
Решение. Из табл.1 lgK(NiY2-) = 18,6, т.е. K(NiY2-) = 4·1018, а lgK(СаY2-) = 10,7, т.е. K(СаY2-) = 5·1010.
а) рН=5. Из табл.2 (Y4-) = 3,5·10-7. Тогда по (2.3):
K’(NiY2-) = 4·1018·3,5·10-7= 1,4·1012> 108, количественное определение никеля возможно.
K’(СаY2-) = 5·1010·3,5·10-7= 1,75·104< 108, количественное определение кальция невозможно.
б) рН=9. Из табл.2 (Y4-) = 5,2·10-2. Тогда по (2.3):
K’(NiY2-) = 4·1018·3,5·10-2= 1,4·1017> 108, количественное определение никеля возможно.
K’(СаY2-) = 5·1010·5,2·10-2= 2,6·109> 108, количественное определение кальция возможно.
Из приведенного примера видно, что ионы кальция можно определять только в щелочной среде, так как его малоустойчивый комплекс с ЭДТА разрушается уже в слабокислой среде. Более прочный комплексонат никеля устойчив и при рН = 5, однако, в более кислой среде (рН=2, K’ = 4·1018·3,7·10-14 = 1,5·105< 108) количественное определение никеля становится невозможным. При такой кислотности могут существовать только комплексонаты с большой константой устойчивости (lgK > 22). Таким образом, варьируя кислотность реакционной среды, можно осуществлять селективное определение металлов в смеси.
