
- •1.Классификация и номенклатура ферментов
- •4) Структура белковой молекулы
- •5) Роль поджелудочной железы в пищеварении
- •7) Строение и биологическая роль днк
- •8)Биосинтез холерестерина и его биологическая роль.
- •9)Классификация витаминов.
- •10) .Роль желчных кислот, переваривание липидов
- •11) Характеристика гормонов поджелудочной железы
- •12) Переваривание углеводов
- •13) Пути обезвреживания амиака арнетиновой кислоты
- •15) Характеристика витаминов(в2 и в5)
- •17) Физико-химические свойства белков
- •1. Различия белков по форме молекул
- •2. Различия белков по молекулярной массе
- •3. Суммарный заряд белков
- •4. Соотношение полярных и неполярных групп на поверхности нативных молекул белков
- •5. Растворимость белков
- •19)Ферменты биологического окисления
- •20)Взаимосвязь аминоуглеводов с обменом липидов
- •22. Гнилостный распад белков
- •23) Факторы, влияющие на скорость ферментативных реакций
- •24.Синтез жиров из продуктов углеводного обмена
- •25.Классификация простых белков
- •28)Основные биологические свойства белков
- •31) Виды обратимого и необратимого осаждения белков
- •32) Классификация углеводов.
- •33)Переваривание белков в клетках тканей
- •34) Классификация сложных белков
- •35)Цикл Кребса
- •45) Взаимосвязь обмена углеводов,липидов и белков
- •46)Общие пути превращения аминокислот в тканях
28)Основные биологические свойства белков
Свойства белков
1. Разная растворимость в воде. Растворимые белки образуют коллоидные растворы.
2. Гидролиз - под действием растворов минеральных кислот или ферментов происходит разрушение первичной структуры белка и образование смеси аминокислот.
3. Денатурация - частичное или полное разрушения пространственной структуры, присущей данной белковой молекуле. Денатурация происходит под действием:
- высокой температуры
- растворов кислот, щелочей и концентрированных растворов солей
- растворов солей тяжёлых металлов
- некоторых органических веществ (формальдегида, фенола)
- радиоактивного излучения
Свойства белков и их биологические функции определяются последовательностью аминокислот. Работы по выяснению первичной структуры белка впервые были выполнены в Кембриджском университете на примере одного из простейших белков - инсулина. В течение посте 10 лет английский биохимик Ф.Сенгер проводил анализ инсулина. В результате анализа выяснено, что молекула инсулина состоит из двух полипептидных цепей и содержит 51 аминокислотный остаток. Он установил, что инсулин имеет молярную массу 5687 г/моль, а его химический состав отвечает формуле C254H337N65O75S6. Анализ проводился вручную с использованием ферментов, которые избирательно гидролизуют пептидные связи между определёнными аминокислотными остатками.
В настоящее время большая часть работы по определению первичной структуры белков автоматизирована. Так была установлена первичная структура фермента лизоцима.
Тип "укладки" полипептидной цепочки называют вторичной структурой. У большинства белков полипептидная цепь свёртывается в спираль, напоминающую "растянутую пружину" (называю "А-спираль" или "А-стуктура"). Еще один распространённый тип вторичной структуры - структура складчатого листа (называют "B - структура"). Так, белок шёлка - фиброин имеет именно такую структуру. Он состоит из ряда полипептидных цепей, которые располагаются параллельно друг-другу и соединяются посредством водородных связей, большое число которых делает шёлк очень гибким и прочным на разрыв.
При всём этом практически не существует белков, молекулы которых на 100% имеют "А-структуру" или "B - структуру".
Пространственное положение полипептидной цепи называют третичной структурой белкой. Большинство белков относят к глобулярным, потому что их молекулы свёрнуты в глобулы. Такую форму белок поддерживает благодаря связям между разнорзяряженными ионами (-COO- и -NH3+ и дисульфидных мостиков. Кроме того, молекула белка свёрнута так, что гидрофобные углеводородные цепи оказываются внутри глобулы, а гидрофильные - снаружи.
Способ объединения нескольких молекул белка в одну макромолекулу называют четвертичной стуктурой белка. Ярким примером такого белка может быть гемоглобин. Было установлено, что, например, для взрослого человека молекула гемоглобина состоит из 4-х отдельных полипептидных цепей и небелковой части - гема.
Свойства белков объясняет их различное строение. Большинство белков аморфно, в спирте, эфире и хлороформе нерастворимо. В воде некоторые белки могут растворяться с образованием коллоидного раствора. Многие белки растворимы в растворах щелочей, некоторые - в растворах солей, а некоторые - в разбавленном спирте. Кристаллическое состояние белов встречается редко: примером могут быть алейроновые зёрна, встречающиеся в клещевине, тыкве, конопле. Кристаллизуется также альбумин куриного яйца и гемоглобин в крови.
При кипячении с кислотами или щелочами, а также под действием ферментов белки распадаются на более простые химические соединения, образуя в конце цепочки превращения смесь A-аминокислот. Такое расщепление называется гидролизом белка. Гидролиз белка имеет большое биологическое значение: попадая в желудок и кишечник животного или человека, белок расщепляется под действием ферментов на аминокислоты. Образовавшиеся аминокислоты в дальнейшем под влиянием ферментов снова образуют белки, но уже характерные для данного организма!
В продуктах гидролиза белков кроме аминокислот были найдены углеводы, фосфорная кислота, пуриновые основания. Под влиянием некоторых факторов например, нагревания,растворов солей, кислот и щелочей, действия радиации, встряхивания, может нарушиться пространственная структура, присущая данной белковой молекуле. Денатурация может носить обратимый или необратимый характер, но в любом случае аминокислотная последовательность, то есть первичная структура, остаётся неизменной. В результате денатурации белок перестаёт выполнять присущие ему биологические функции.
Для белков известны некоторые цветные реакции, характерные для их обнаружения. При нагревании мочевины образуется биурет, который с раствором сульфата меди в присутствии щелочи даёт фиолетовое окрашивание или качественная реакция на белок, которую можно провести дома). Биуретовую реакцию даёт вещества, содержащие амидную группу, а в молекуле белка эта группа присутствует.
Ксантопротеиновая реакция заключается в том, что белок от концентрированной азотной кислоты окрашивается в жёлтый цвет. Эта реакция указывает на наличие в белке бензольной группировки, которая имеется в таких аминокислотах, как фениланин и тирозин.
При кипячении с водным раствором нитрата ртути и азотистой кислоты, белок даёт красное окрашивание. Эта реакция указывает на наличие в белке тирозина. При отсутствии тирозина красного окрашивания не появляется
29)биосинтез триглицеридов. Известно, что скорость биосинтеза жирных кислот во многом определяется скоростью образования триглицеридов ифосфолипидов, так как свободные жирные кислоты присутствуют втканях и плазме крови в небольших количествах и в норме не накапливаются.
Синтез триглицеридов происходит из глицерина и жирных кислот(главным образом стеариновой, пальмитиновой и олеиновой). Путьбиосинтеза триглицеридов в тканях протекает через образование α-глице-рофосфата (глицерол-3-фосфата) как промежуточного соединения.
В почках, а также в стенке кишечника, где активность ферментаглицеролкиназы высока, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата:
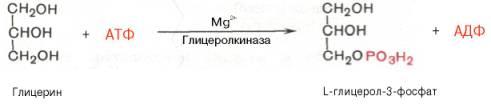
В жировой ткани и мышцах вследствие очень низкой активности глицеролкиназы образование глицерол-3-фосфата в основном связано с процессами гликолиза и гликогенолиза. Известно, что в процессе гли-колитического распада глюкозы образуется дигидроксиацетонфосфат (см. главу 10). Последний в присутствии цитоплазматической глицерол-3-фосфатдегидрогеназы способен превращаться в глицерол-3-фосфат:

Отмечено, что если содержание глюкозы в жировой ткани понижено (например, при голодании), то образуется лишь незначительное количество глицерол-3-фосфата и освободившиеся в ходе липолиза свободные жирные кислоты не могут быть использованы для ресинтеза триглицеридов, поэтому жирные кислоты покидаютжировую ткань. Напротив, активация гликолиза в жировой ткани способствует накоплению в ней триглицеридов, а также входящих в их состав жирных кислот. В печени наблюдаются оба пути образования глицерол-3-фосфата.
Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекуламиКоА-производного жирной кислоты (т.е. «активными» формами жирной кислоты – ацил-КоА). В результате образуется фосфатидная кислота (фосфатидат):
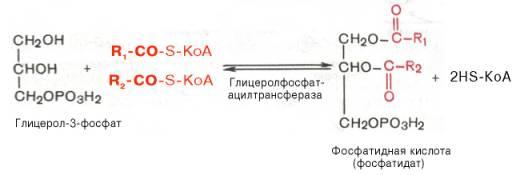
Как отмечалось, ацилирование глицерол-3-фосфата протекает последовательно, т.е. в 2 этапа. Сначала глицерол-3-фосфат-ацилтрансфераза катализирует образование лизофосфатидата (1-ацилглицерол-3-фосфата, а затем 1-ацилглицерол-3-фосфат-ацилтрансфераза катализирует образование фосфатидата (1,2-диацилглицерол-3-фосфата) .
Далее фосфатидная кислота гидролизуется фосфатидат-фосфогидро-лазой до 1,2-диглицерида (1,2-диацилглицерола):

Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицерол-ацилтрансферазой:

Синтез триглицеридов (триацилглицеролов) в тканях происходит с учетом двух путей образования глицерол-3-фосфата и возможности синтеза триглицеридов в стенке тонкой кишки из β-моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевых жиров. На рис. 11.6 представлены глицерофосфатный, дигидроксиацетон-фосфатный и β-моноглицеридный (моноацилглицероловый) пути синтеза триглицеридов.

Рис. 11.6. Биосинтез триглицеридов (триацилглицеролов).
Установлено, что большинство ферментов, участвующих в биосинтезе триглицеридов, находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерол-3-фосфат-ацилтрансфераза,– вмитохондриях.
30)гормоны надпочечников. Щитовидная железа играет исключительно важную роль в обмене веществ. Об этом свидетельствуют резкое изменение основного обмена, наблюдаемое при нарушениях деятельности щитовидной железы, а также ряд косвенных данных, в частности обильное ее кровоснабжение несмотря на небольшую массу (20–30 г). Щитовидная железа состоит из множества особых полостей – фолликулов, заполненных вязким секретом – коллоидом. В составколлоида входит особый йодсодержащий гликопротеин с высокой мол. массой – порядка 650000 (5000 аминокислотных остатков). Этот глико-протеин получил название йодтиреоглобулина. Он представляет собой запасную форму тироксина и трийодтиронина – основных гормонов фолликулярной части щитовидной железы.
Помимо этих гормонов (биосинтез и функции которых будут рассмотрены ниже), в особых клетках – так называемых парафолликулярных клетках, или С-клетках щитовидной железы, синтезируется гормон пептидной природы, обеспечивающий постоянную концентрацию кальция в крови. Он получил название «кальцитонин». Впервые на существование кальцито-нина, обладающего способностью поддерживать постоянный уровенькальция в крови, указал в 1962 г. Д. Копп, который ошибочно считал, что этот гормон синтезируется паращитовидными железами. В настоящее время кальцитонин не только выделен в чистом виде изткани щитовидной железы животных и человека, но и полностью раскрыта 32-членная аминокислотная последовательность, подтвержденная химическим синтезом. Ниже приведена первичная структура кальцитонина, полученного из щитовидной железы человека:

Кальцитонин человека содержит дисульфидный мостик (между 1-м и 7-м аминокислотными остатками) и характеризуется N-концевым цистеином и С-концевым пролинамидом. Кальцитонины быка, овцы, свиньи и лососевых рыб мало отличаются друг от друга как по структуре и концевым аминокислотам, так и по гипокальциемической активности. Биологическое действие кальцитонина прямо противоположно эффектупаратгормона: он вызывает подавление в костной ткани резорбтивных процессов и соответственно гипокальциемию и гипофосфатемию. Таким образом, постоянство уровня кальция в крови человека и животных обеспечивается главным образом паратгормоном, кальцитриолом и кальцитонином, т.е. гормонамикак щитовидной и паращитовидных желез, так и гормоном – производным витамина D3. Это следует учитывать при хирургических лечебных манипуляциях на данных железах.
Химическая природа гормонов фолликулярной части щитовидной железы выяснена в деталях сравнительно давно. Считается установленным, что все йодсодержащие гормоны, отличающиеся друг от друга содержанием йода, являются производными L-тиронина, который синтезируется в организме изаминокислоты L-тирозина.

Из L-тиронина легко синтезируется гормон щитовидной железы тироксин, содержащий в 4 положениях кольцевой структуры йод. Следует отметить, что гормональной активностью наделены 3,5,3'-трийодтиронин и 3,3'-дийодтиронин, также открытые в щитовидной железе. Биосинтез гормонов щитовидной железы регулируется тиротропином – гормоном гипоталамуса (см. ранее).
В настоящее время еще полностью не изучены ферментные системы, катализирующие промежуточные стадии синтеза этих гормонов, и природа фермента, участвующего в превращении йодидов в свободный йод(2IДI2), необходимый для йодирования 115 остатков тирозина в молекуле тиреоглобулина. Последовательность реакций, связанных с синтезом гормонов щитовидной железы, была расшифрована при помощи радиоактивного йода [131I]. Было показано, что введенный меченый йод прежде всего обнаруживается в молекуле монойодтирозина, затем - дийодтирозина и только потом – тироксина. Эти данные позволяли предположить, что монойод- и дийодтирозины являются предшественниками тироксина. Однако известно также, что включение йода осуществляется не на уровне свободного тироксина, а на уровне полипептидной цепи тиреоглобулина в процессе его постсинтетической модификации в фолликулярных клетках. Дальнейшийгидролиз тиреоглобулина под действием протеиназ и пептидаз приводит к образованию как свободныхаминокислот, так и к освобождению йодтиронинов, в частности тироксина, последующее депонирование которого способствует образованию трийодтиронина. Эта точка зрения кажется более правдоподобной с учетом универсальности постсинтетической химической модификации при биосинтезе биологически активныхвеществ в организме.
Катаболизм гормонов щитовидной железы протекает по двум направлениям: распад гормонов с освобождением йода (в виде йодидов) и дезами-нирование (отщепление аминогруппы) боковой цепигормонов. Продукты обмена или неизмененные гормоны экскретируются почками или кишечником. Возможно, что некоторая часть неизмененного тироксина, поступая через печень и желчь в кишечник, вновь всасывается, пополняя резервы гормонов в организме.
Биологическое действие гормонов щитовидной железы распространяется на множество физиологических функций организма. В частности, гормоны регулируют скорость основного обмена, рост и дифференцировкутканей, обмен белков, углеводов и липидов, водно-электролитный обмен, деятельность ЦНС, пищеварительного тракта, гемопоэз, функцию сердечнососудистой системы, потребность в витаминах, сопротивляемость организма инфекциям и др. Точкой приложения действия тиреоидных гормонов, как и всехстероидов (см. далее), считается генетический аппарат. Специфические рецепторы – белки – обеспечивают транспорт тиреоидных гормонов в ядро и взаимодействие со структурными генами, в результате чего увеличивается синтез ферментов, регулирующих скорость окислительно-восстановительных процессов. Естественно поэтому, что недостаточная функция щитовидной железы (гипофункция) или, наоборот, повышенная секреция гормонов (гиперфункция) вызывает глубокие расстройства физиологического статусаорганизма.
Гипофункция щитовидной железы в раннем детском возрасте приводит к развитию болезни, известной в литературе как кретинизм. Помимо остановки роста, специфических изменений кожи, волос, мышц, резкого снижения скорости процессов обмена, при кретинизме отмечаются глубокие нарушения психики; специфическое гормональное лечение в этом случае не дает положительных результатов.
Недостаточная функция щитовидной железы в зрелом возрасте сопровождается развитием гипотиреоидного отека, или микседемы (от греч. myxa – слизь, oedemo – отек). Это заболевание чаще встречается у женщин и характеризуется нарушением водно-солевого, основного и жирового обмена. У больных отмечаются слизистый отек, патологическое ожирение, резкое снижение основного обмена, выпадение волос и зубов, общие мозговые нарушения и психические расстройства. Кожа становится сухой, температура тела снижается; в крови повышено содержание глюкозы. Гипотиреоидизм сравнительно легко поддается лечению препаратами щитовидной железы.
Следует отметить еще одно поражение щитовидной железы – эндемический зоб. Болезнь обычно развивается у лиц, проживающих в горных местностях, где содержание йода в воде и растениях недостаточно. Недостатокйода приводит к компенсаторному увеличению массы ткани щитовидной железы за счет преимущественного разрастания соединительной ткани, однако этот процесс не сопровождается увеличением секрециитиреоидных гормонов. Болезнь не приводит к серьезным нарушениям функций организма, хотя увеличенная в размерах щитовидная железа создает определенные неудобства. Лечение сводится к обогащению продуктов питания, в частности поваренной соли, неорганическим йодом.
Повышенная функция щитовидной железы (гиперфункция) вызывает развитие гипертиреоза, известного в литературе под названием «зоб диффузный токсический» (болезнь Грейвса, или базедова болезнь). Резкое повышение обмена веществ сопровождается усиленным распадом тканевых белков, что приводит к развитию отрицательного азотистого баланса. Наиболее характерным проявлением болезни считается триада симптомов: резкое увеличение числа сердечных сокращений (тахикардия), пучеглазие (экзофтальм) и зоб, т.е. увеличенная в размерах щитовидная железа; у больных отмечаются общее истощение организма, а также психические расстройства.
При гиперфункции щитовидной железы и, в частности, токсическом зобе показано оперативное удаление всей железы или введение 131I (β- и γ-излу-чение частично разрушает ткань железы) и антагонистов тироксина, тормозящих синтез тиреоидных гормонов. К подобным веществам относятся, например, тиомочевина, тиоурацил (или метилтиоурацил).

Снижают функцию щитовидной железы тиоцианат и вещества, содержащие аминобензольную группу, а также микродозы йода. Механизм действия антитиреоидных веществ окончательно не выяснен. Возможно, они оказывают ингибирующее действие на ферментные системы, участвующие в биосинтезе тиреоидныхгормонов.
